Enlace iónico y enlace covalente
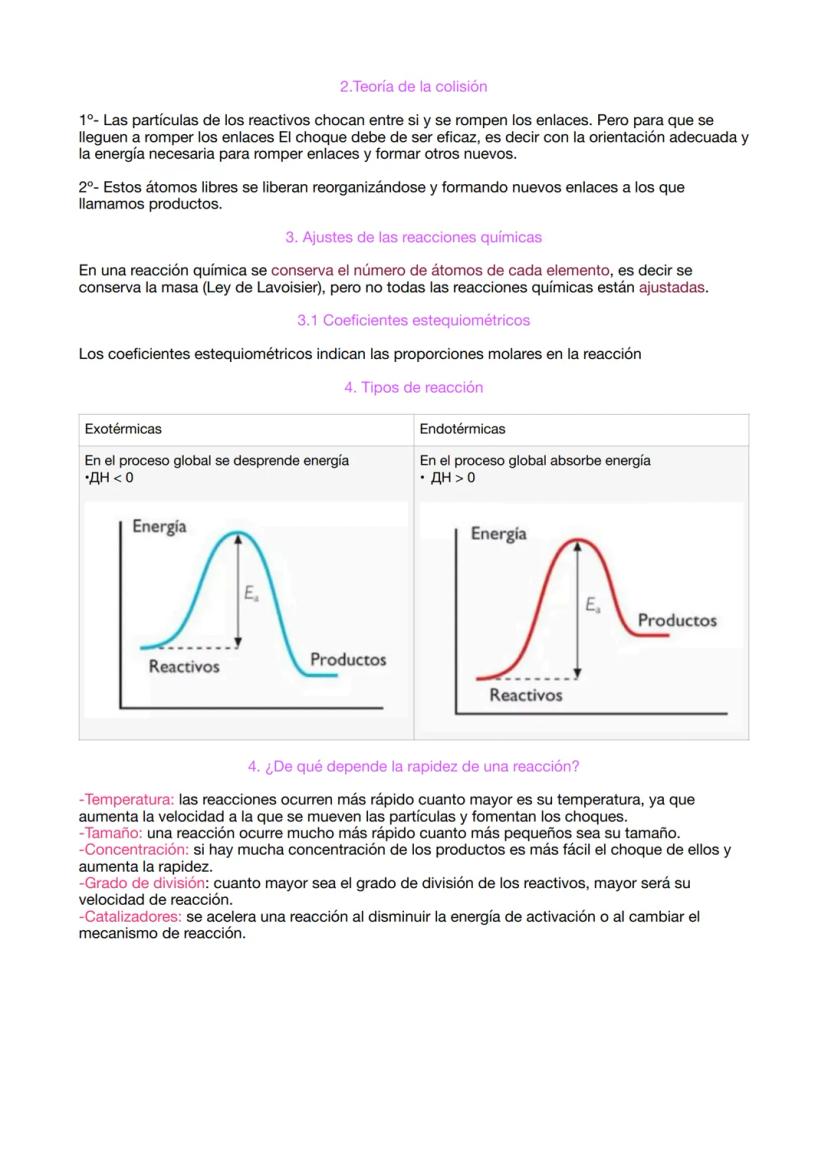
El enlace iónico ocurre cuando un metal "regala" electrones a un no metal. El metal se convierte en catión (positivo) y el no metal en anión (negativo), y se atraen como imanes opuestos. Este tipo de enlace forma cristales, no moléculas individuales. El ejemplo clásico es la sal común (NaCl): el sodio le da un electrón al cloro.
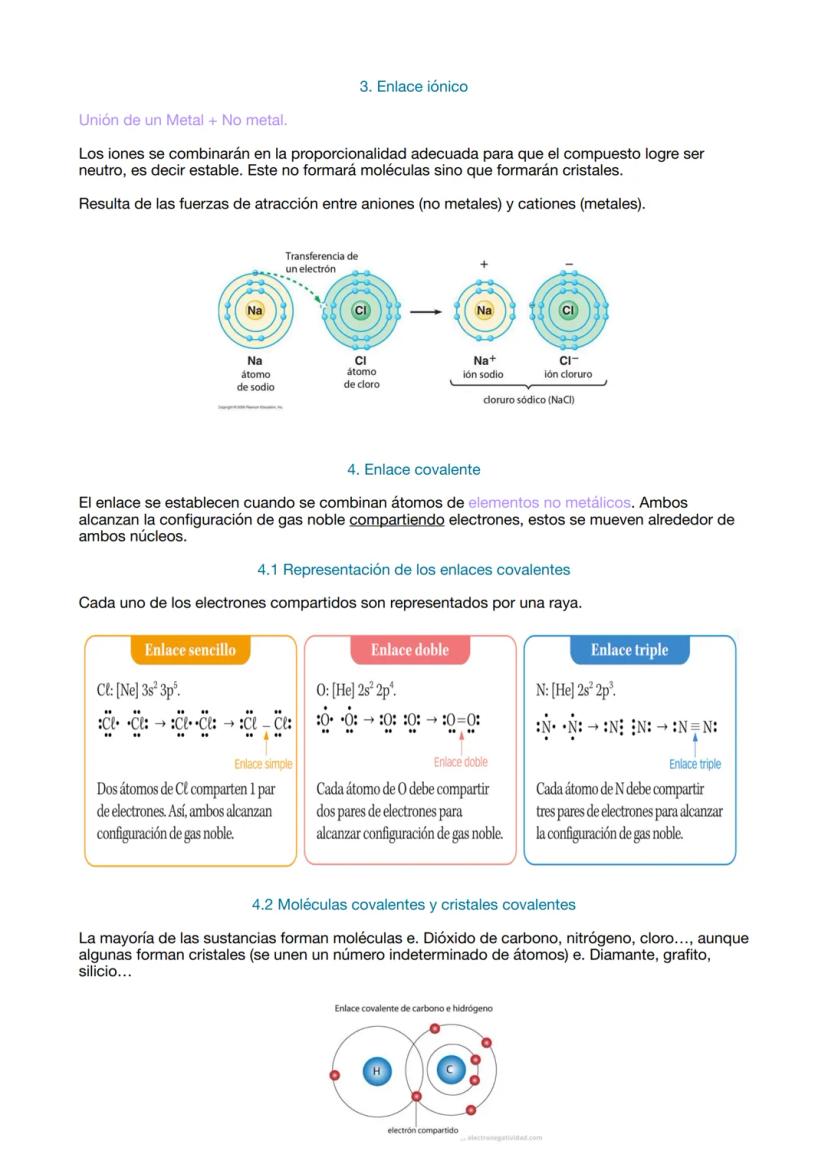
El enlace covalente es más democrático: los no metales comparten electrones para que ambos consigan la configuración de gas noble. Es como dos amigos compartiendo una pizza para que los dos queden satisfechos.
Los enlaces covalentes pueden ser simples (una raya), dobles (dos rayas) o triples (tres rayas), dependiendo de cuántos pares de electrones compartan. El cloro comparte uno, el oxígeno dos, y el nitrógeno tres.
La mayoría de sustancias covalentes forman moléculas como el CO₂ o el N₂, pero algunas forman cristales covalentes gigantes como el diamante. En ambos casos, los átomos comparten electrones que se mueven alrededor de ambos núcleos.
Para recordar: Iónico = transferir electrones, Covalente = compartir electrones. ¡Como prestar vs compartir tus apuntes!