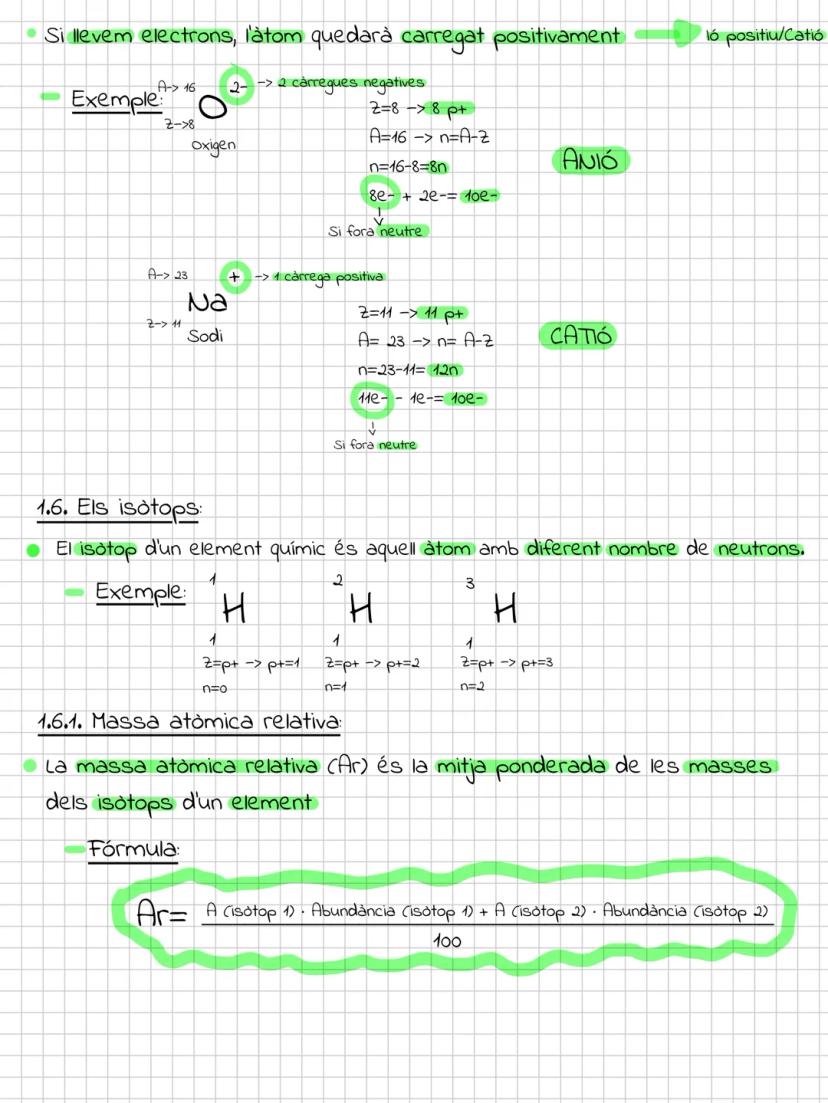
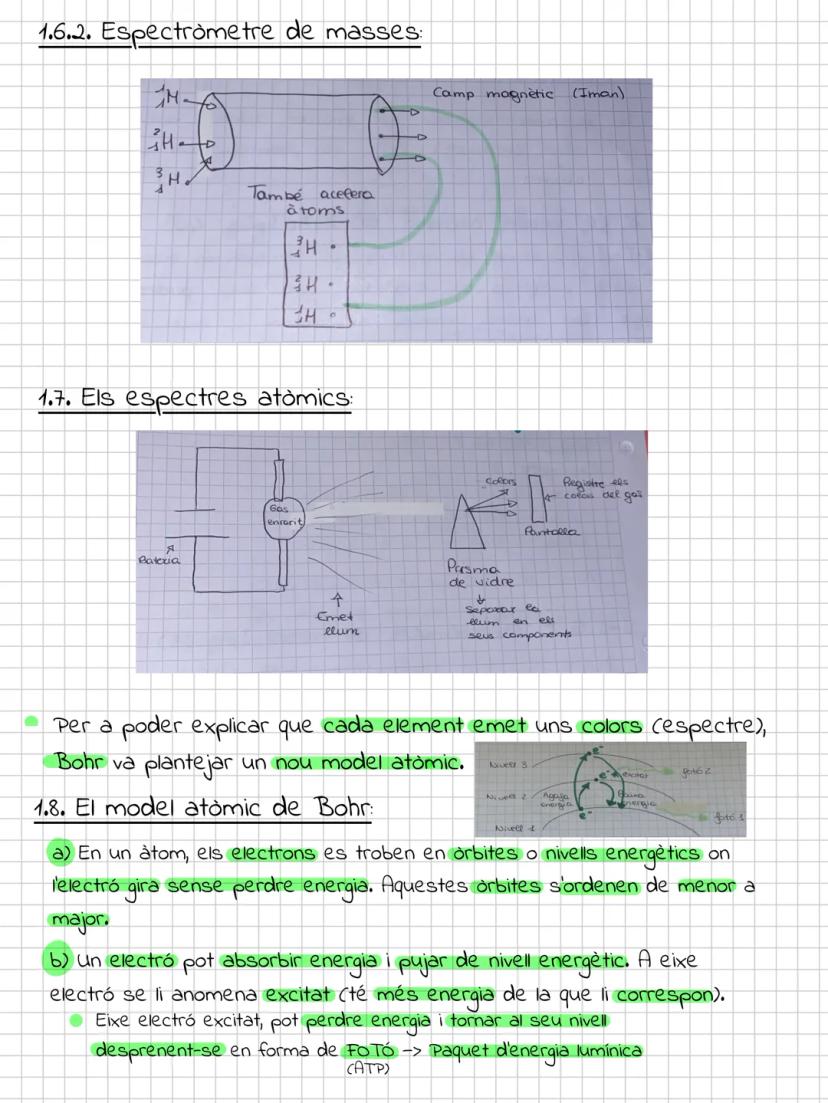
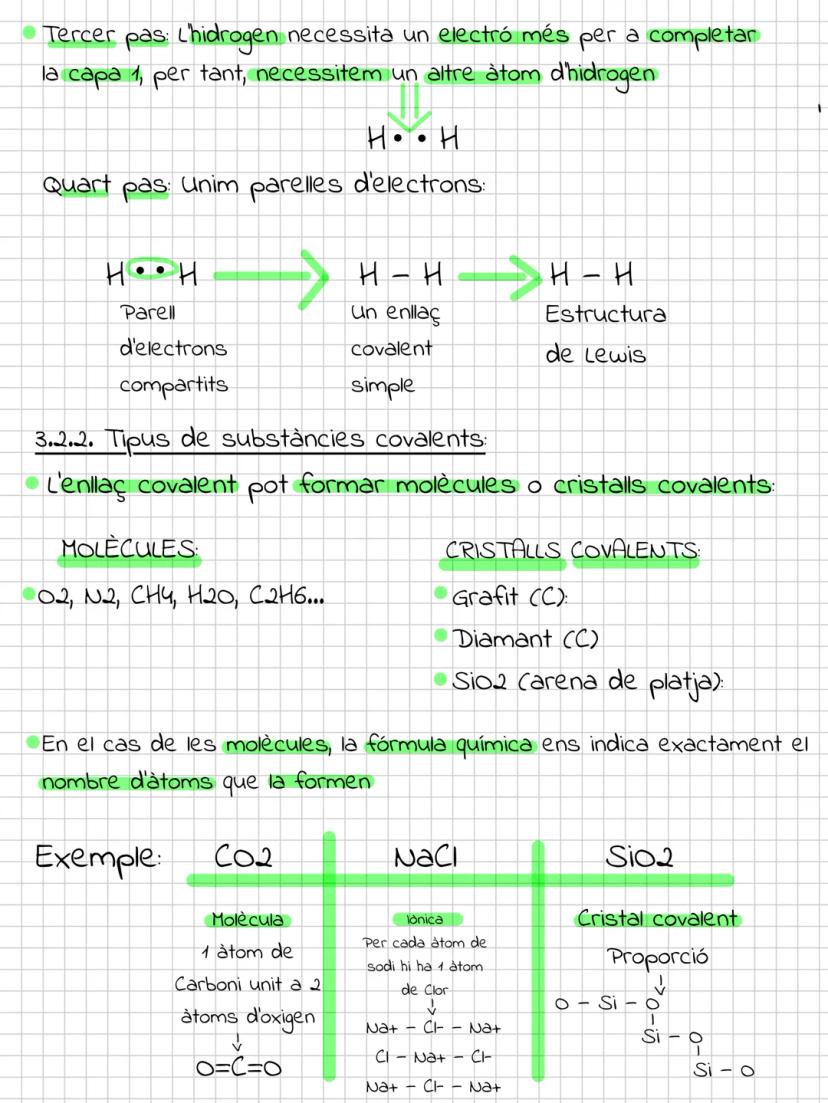
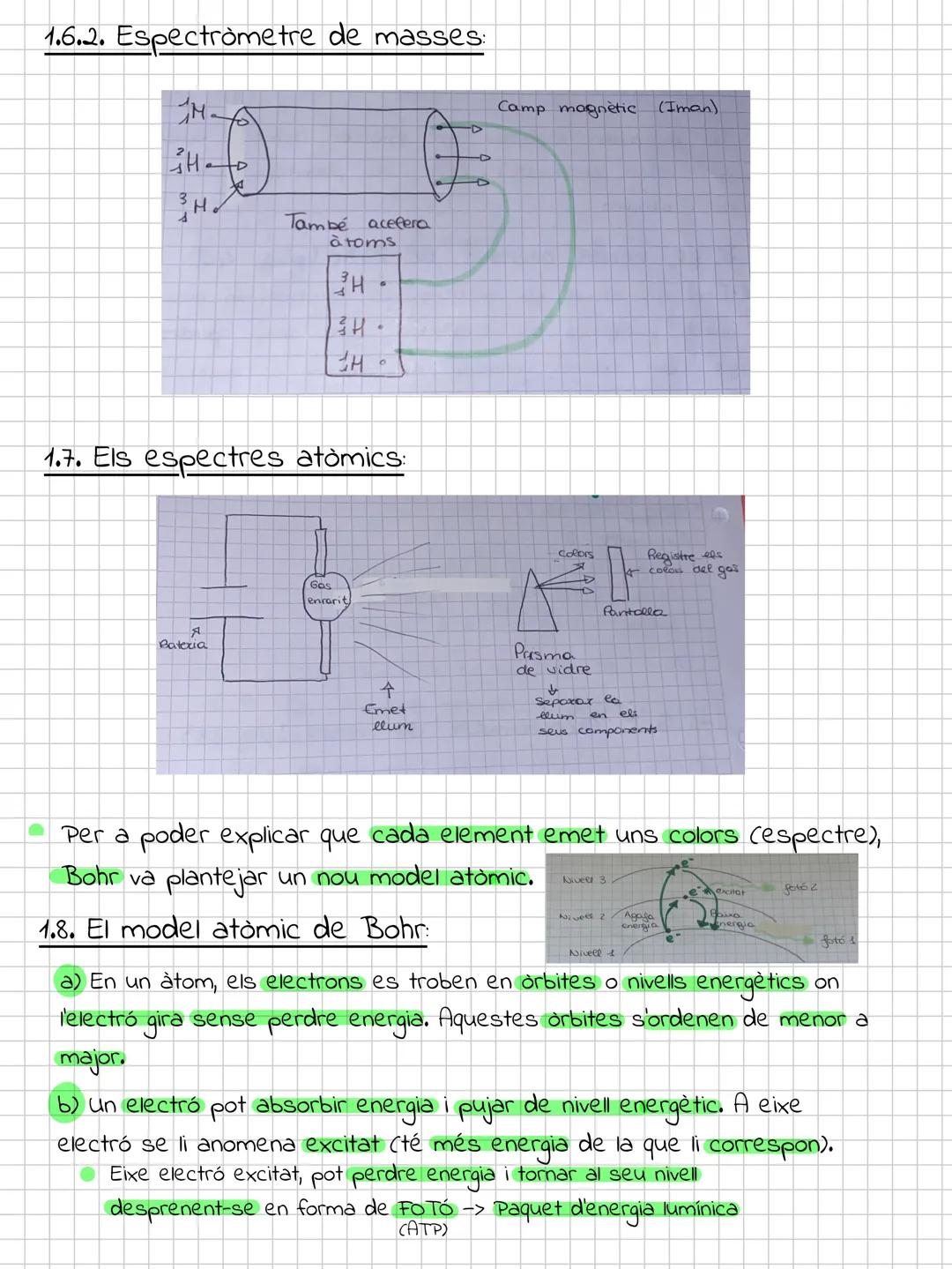
El modelo actual y los orbitales
El modelo actual del átomo es mucho más sofisticado gracias a Schrödinger y su ecuación. Los electrones no giran en órbitas fijas, sino que se mueven en regiones llamadas orbitales, donde es muy probable encontrarlos.
Existen cuatro tipos de orbitales con capacidades diferentes: S (2 electrones), P (6 electrones), D (10 electrones) y F (14 electrones). Cada nivel energético tiene un número específico de orbitales disponibles.
Los niveles se llenan siguiendo un orden preciso: nivel 1 solo tiene orbital S, nivel 2 tiene S y P, nivel 3 tiene S, P y D, y desde el nivel 4 en adelante tienen todos los tipos (S, P, D, F).
La configuración electrónica te dice exactamente cómo se distribuyen los electrones en los orbitales. Para hacerlo correctamente, debes seguir el diagrama de Moeller, que te indica el orden de llenado.
🎯 Clave del éxito: Memoriza las capacidades de los orbitales: S=2, P=6, D=10, F=14. Te ahorrará tiempo en los exámenes.