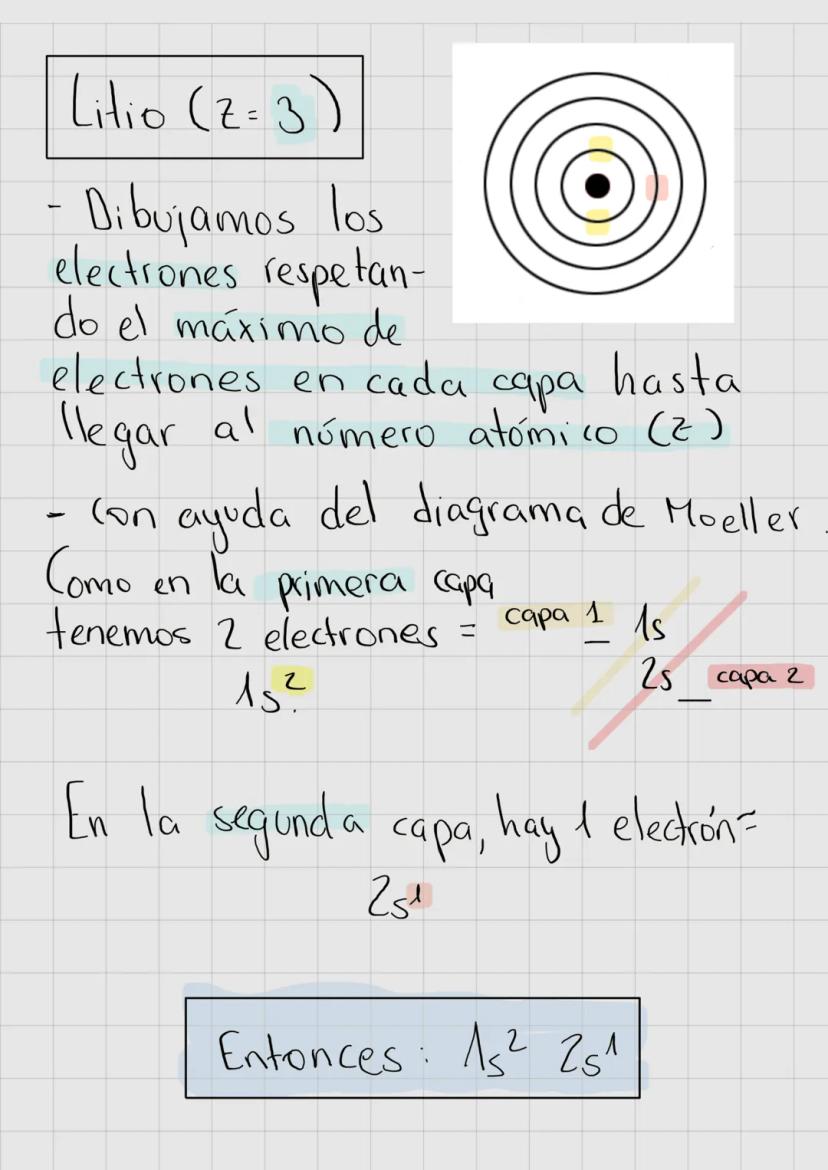
Números Magnético y Espín
El número magnético (m) te dice la orientación específica del orbital en el espacio. Va desde -l hasta +l, pasando por cero. Si l=3, entonces m puede ser -3, -2, -1, 0, 1, 2, 3.
El número espín (s) describe cómo gira el electrón sobre sí mismo. Solo puede ser -1/2 o +1/2. Es como si fuera una moneda que solo puede caer en cara o cruz.
La cantidad de valores de m te dice en qué orbital estás: 1 valor = orbital s, 3 valores = orbital p, 5 valores = orbital d, y 7 valores = orbital f.
Truco para recordar: El orbital s es simple (1), p tiene pocas orientaciones (3), d tiene dos cifras (5), y f tiene full orientaciones (7).