Abundancia isotópica e iones
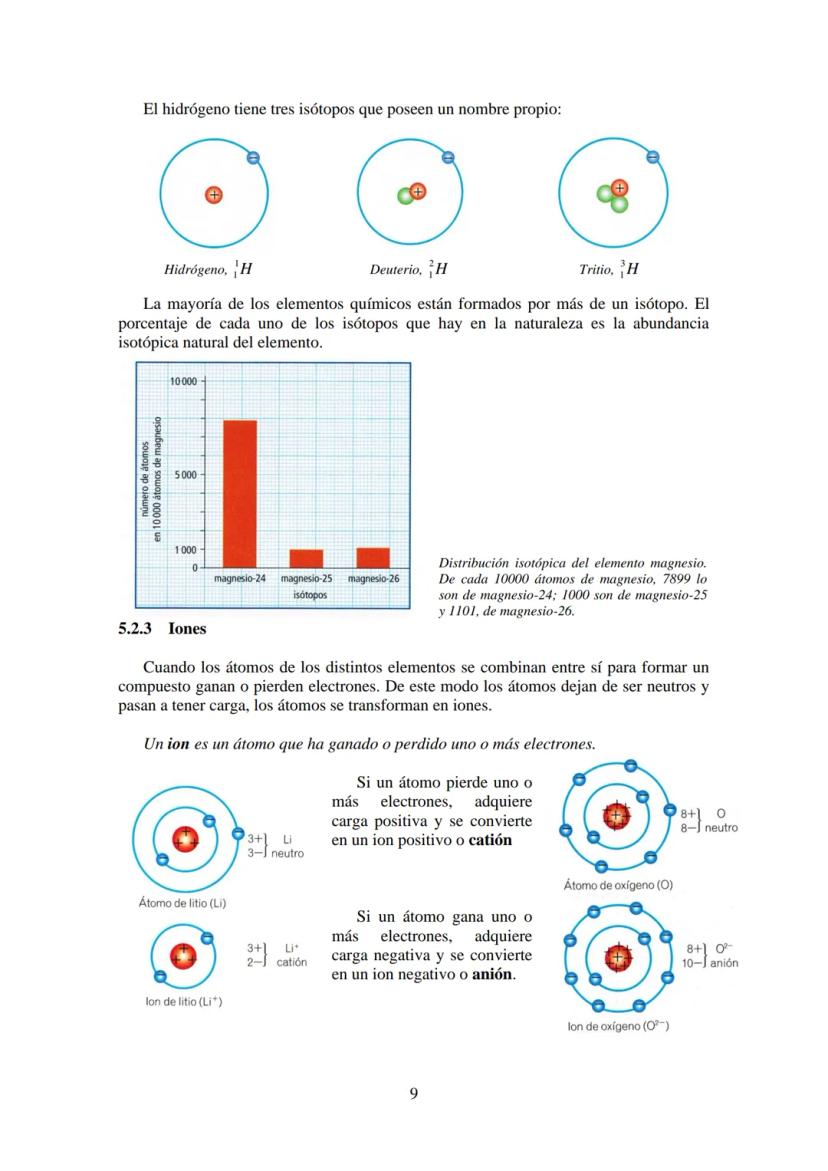
La mayoría de elementos naturales son mezclas de varios isótopos. La abundancia isotópica te dice qué porcentaje de cada isótopo hay en la naturaleza. Por ejemplo, de cada 10.000 átomos de magnesio, 7.899 son magnesio-24.
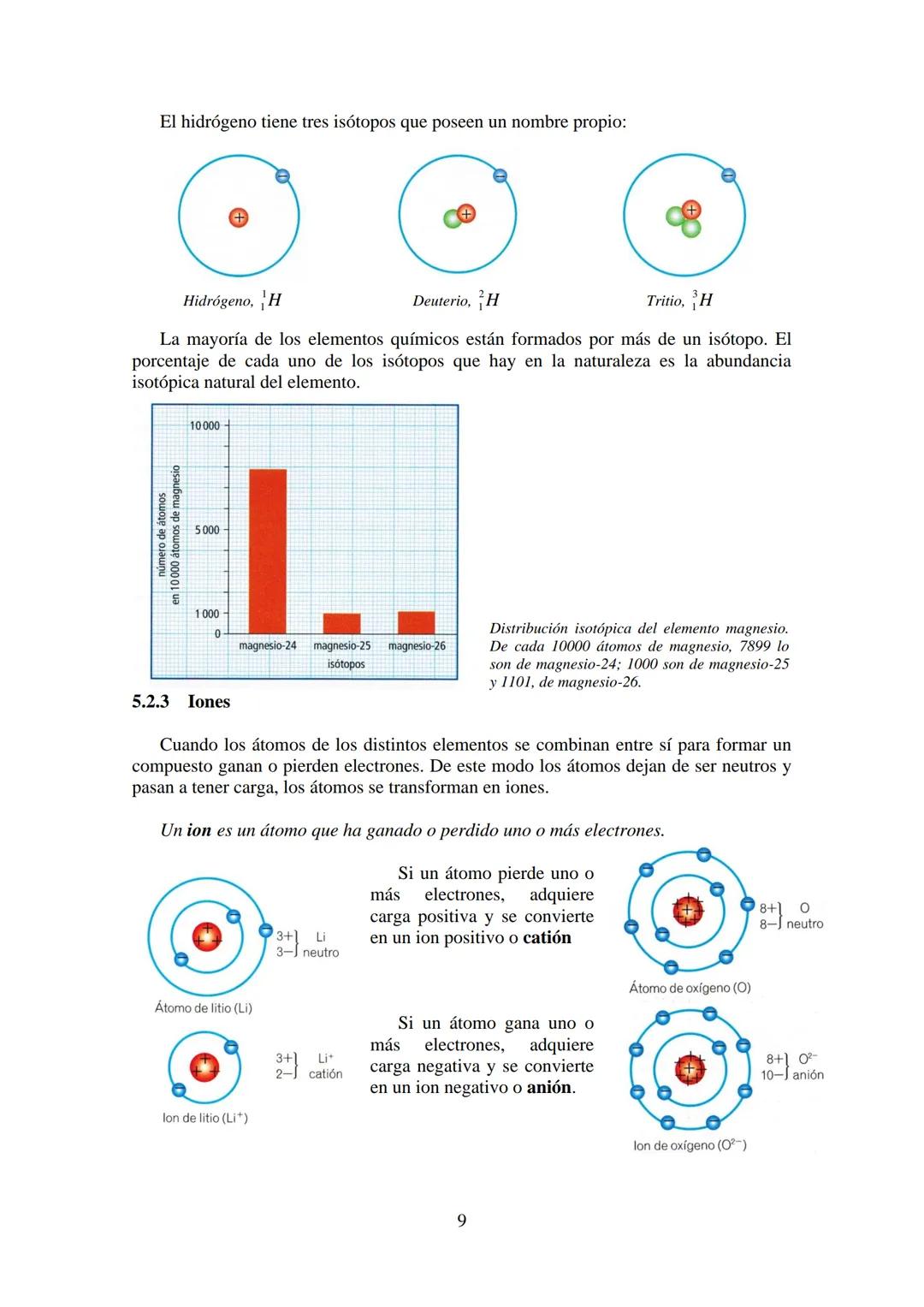
Cuando los átomos se combinan para formar compuestos, pueden ganar o perder electrones. Entonces dejan de ser neutros y se convierten en iones.
Si un átomo pierde electrones, queda con más protones que electrones, así que tiene carga positiva. Se llama catión (como Li⁺). Si gana electrones, tiene más electrones que protones y queda con carga negativa. Se llama anión (como O²⁻).
Los protones nunca cambian en los procesos químicos normales, solo los electrones. Por eso el número atómico siempre identifica al elemento, tenga la carga que tenga.
⚡ Truco para recordar: CATión = CArga posiTiva (perdió electrones), ANión = cArga Negativa (ganó electrones).