Resumen de Patrones y Nomenclatura
Los oxoácidos siguen patrones predecibles según el grupo de la tabla periódica. Grupos XV (P, As, Sb) y XVI (S, Se, Te) forman los sistemas más complejos con prefijos meta-, piro- y orto-.
La nomenclatura sistemática usa números: dihidrógeno (tetraóxido cromato), mientras que la tradicional usa prefijos: ácido crómico. Para exámenes rápidos, domina ambas.
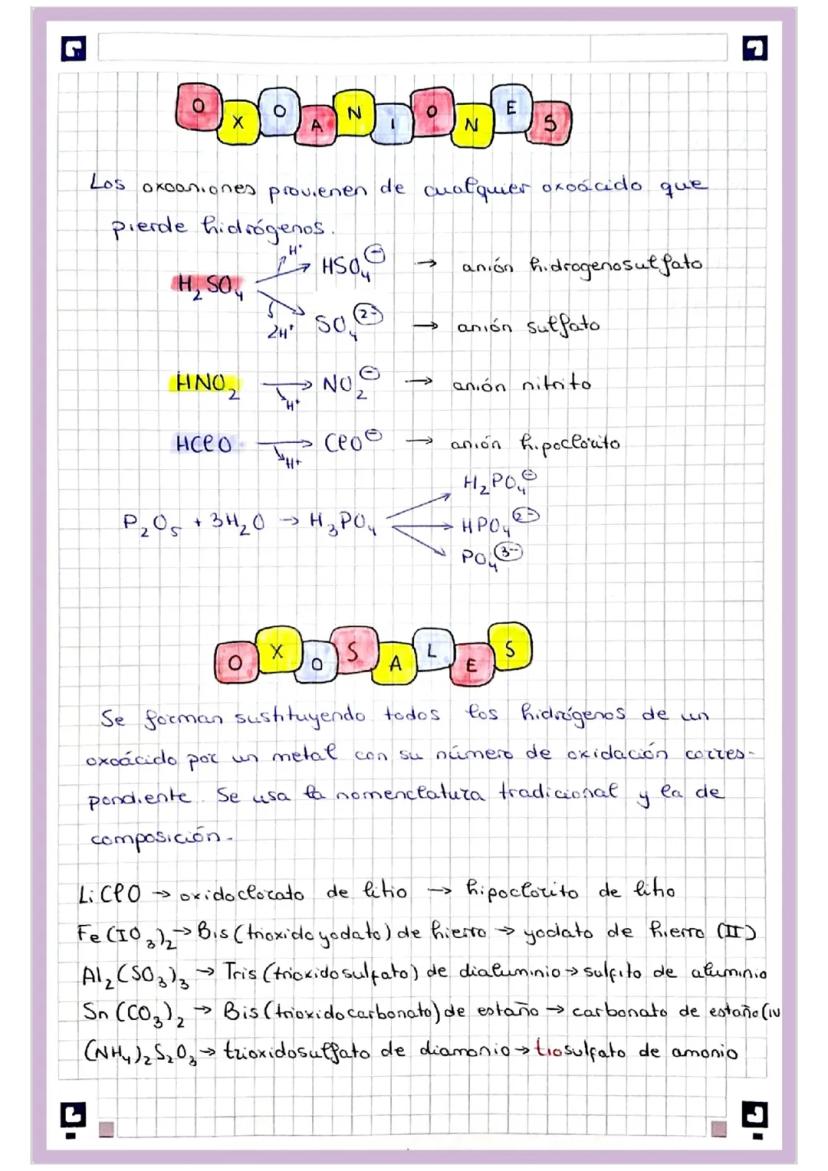
Los oxoaniones se obtienen quitando hidrógenos de oxoácidos, y las sales sustituyendo hidrógenos por metales. La carga siempre debe balancearse perfectamente.
Memoriza las valencias principales: halógenos (1,3,5,7), calcógenos (2,4,6), nitrogenoideos (1,3,5). Con esta base puedes deducir cualquier fórmula.
Estrategia final: Practica escribiendo fórmulas partiendo del elemento central y añadiendo oxígenos según la valencia. ¡La práctica hace al maestro!