Oxoácidos
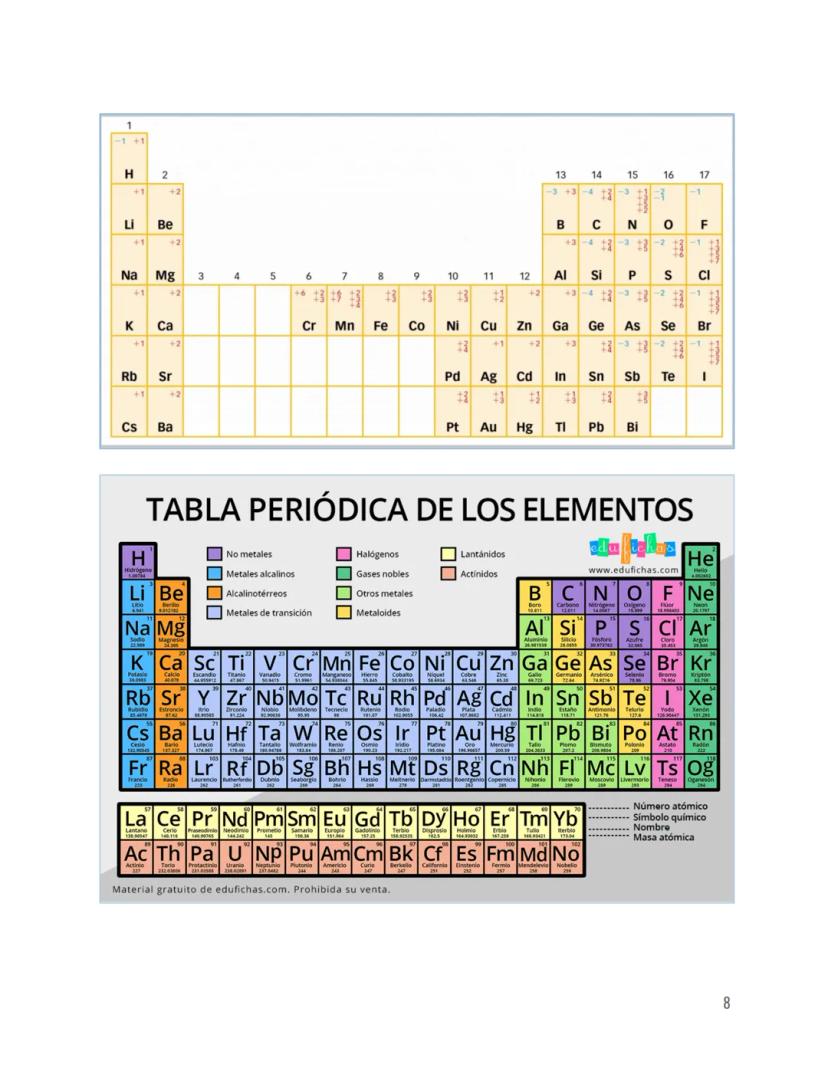
Los oxoácidos son ácidos que contienen hidrógeno, un no metal y oxígeno. Aquí viene la parte que más cuesta, pero tiene truco: las terminaciones -oso/-ico se convierten en -ito/-ato cuando formas sales.
Para el grupo 17 (halógenos), tienes cuatro valencias posibles: +1 (hipo...oso), +3 (...oso), +5 (...ico), y +7 (per...ico). HClO es ácido hipocloroso, HClO₄ es ácido perclórico.
El grupo 16 (azufre y compañía) usa las valencias +2, +4 y +6. H₂SO₃ es ácido sulfuroso, H₂SO₄ es ácido sulfúrico. Lo del "hipo" solo aparece con valencia +2.
Excepción importante: El yodo con valencia +7 puede formar HIO₄ (ácido metaperyódico) o H₅IO₆ (ácido ortoperyódico).
Los grupos 15, 14, 13 y 7 también siguen patrones similares, pero cada uno tiene sus excepciones. El fósforo, por ejemplo, puede formar ácidos meta-, piro- y orto- según cuántas moléculas de agua reaccionen.