Geometría molecular: la forma importa
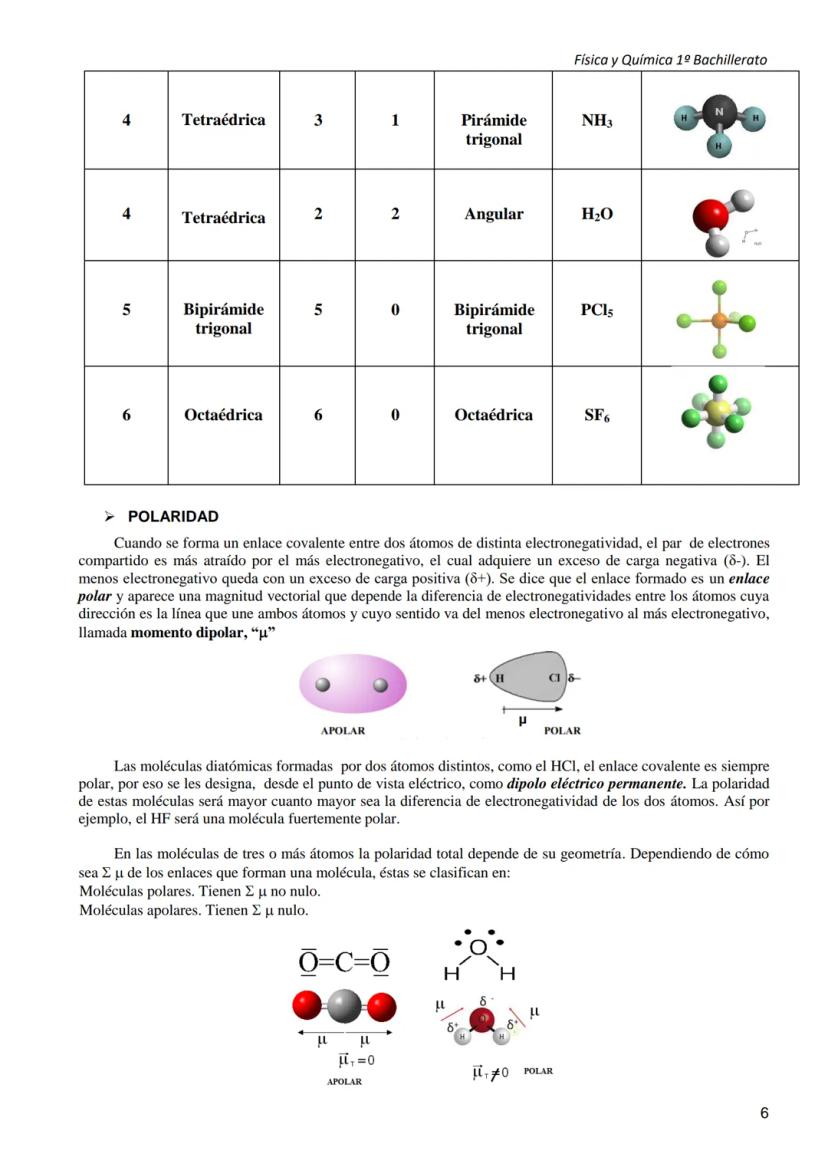
La teoría TRPECV (Teoría de Repulsión de Pares de Electrones de Capa de Valencia) te permite predecir la forma de las moléculas. Su idea básica es genial: los pares de electrones alrededor del átomo central se colocan lo más lejos posible unos de otros para minimizar la repulsión.
El proceso es sistemático: primero dibujas la estructura de Lewis, cuentas los pares de electrones del átomo central, y los distribuyes en el espacio. Las geometrías principales son lineal (2 pares), triangular plana (3 pares), tetraédrica (4 pares), etc.
Los pares no enlazantes (electrones solitarios) ocupan más espacio que los enlazantes, así que "empujan" más. Por eso NH₃ no es tetraédrica perfecta, sino piramidal trigonal: el par solitario del nitrógeno comprime los ángulos de enlace.
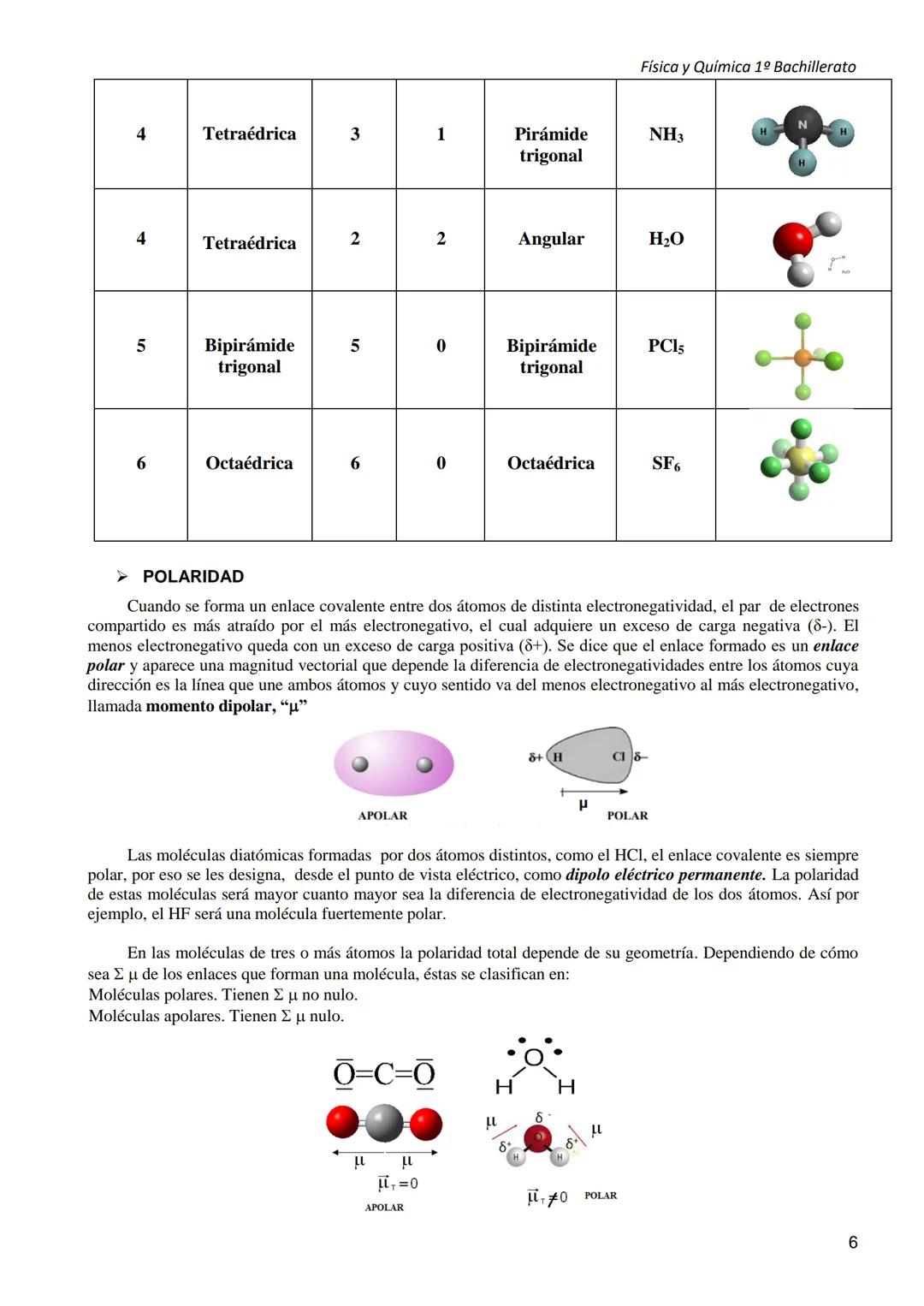
La geometría determina la polaridad molecular. H₂O es polar porque es angular, pero CO₂ es apolar porque es lineal y simétrica.
Regla de oro: PNE-PNE > PNE-PE > PE-PE dondePNE=parnoenlazante,PE=parenlazante.