Estados de la Materia y Teoría Cinético-molecular
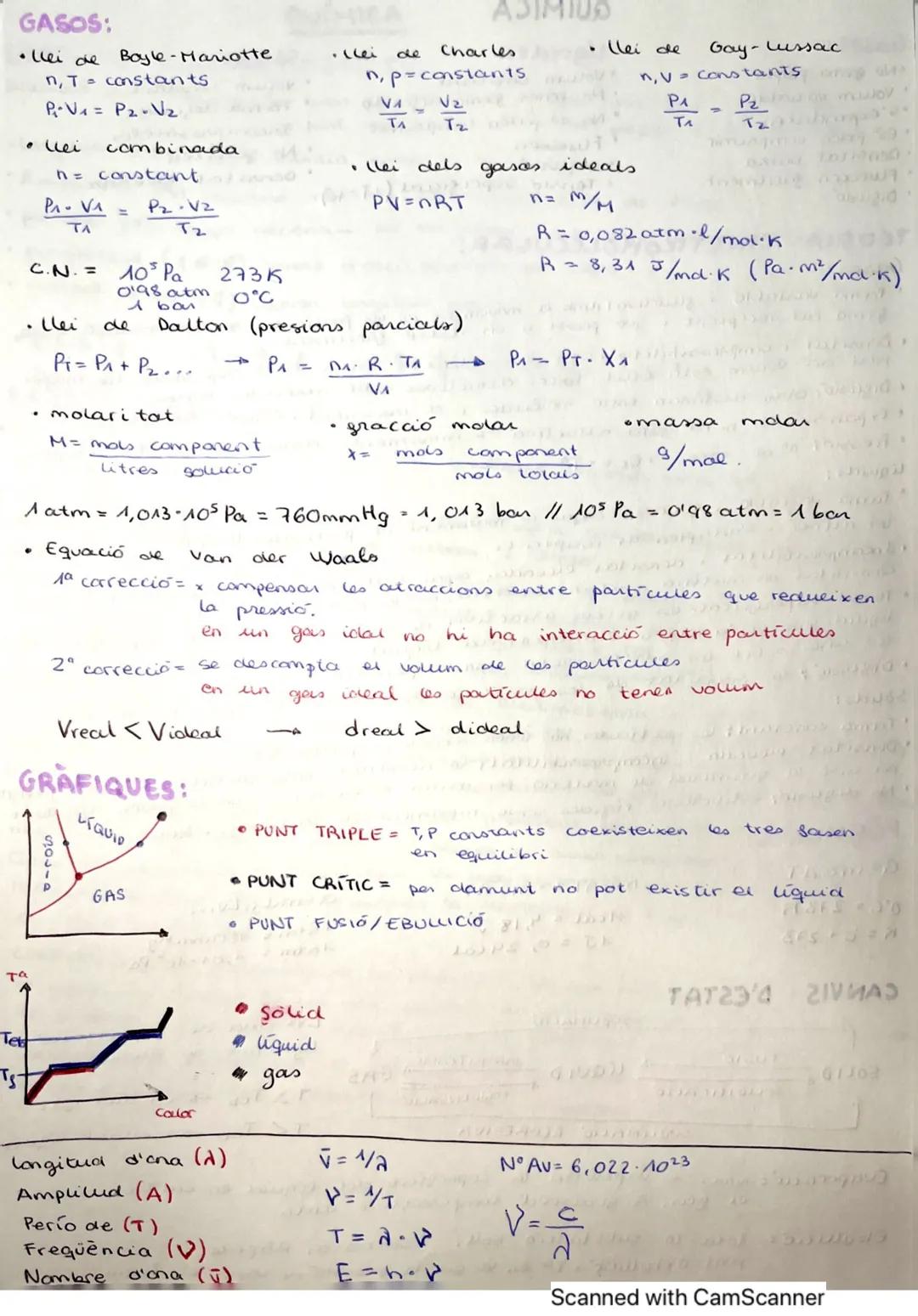
Los estados de la materia se diferencian por sus propiedades físicas. Los gases no tienen forma propia, poseen volumen variable, son compresibles y tienen baja densidad. Los líquidos mantienen volumen constante pero adoptan la forma del recipiente, no son compresibles y presentan tensión superficial.
La teoría cinético-molecular explica estas propiedades: en los gases, las partículas están muy separadas con fuerzas atractivas prácticamente nulas, lo que explica su compresibilidad y expansión. En los líquidos, las partículas pueden deslizarse entre sí pero mantienen proximidad, resultando en incompresibilidad y mayor densidad. Los sólidos tienen partículas en posiciones fijas, lo que les da forma constante y alta densidad.
Los cambios de estado ocurren a temperaturas específicas. La fusión (sólido→líquido) y la vaporización (líquido→gas) requieren absorción de calor, mientras que la solidificación y condensación liberan energía. La evaporación ocurre a cualquier temperatura desde la superficie, mientras que la ebullición implica la vaporización de todo el líquido a una temperatura específica.
💡 Recuerda que la temperatura de ebullición es aquella en la que la presión de vapor iguala la presión atmosférica (1 atm). Por eso los alimentos tardan más en cocinarse en la montaña, donde la presión es menor y el agua hierve a menor temperatura.
Para calcular el calor en cambios de temperatura usamos Q=mcΔT, y para cambios de estado Q=mL (donde L puede ser calor de fusión o vaporización según corresponda).