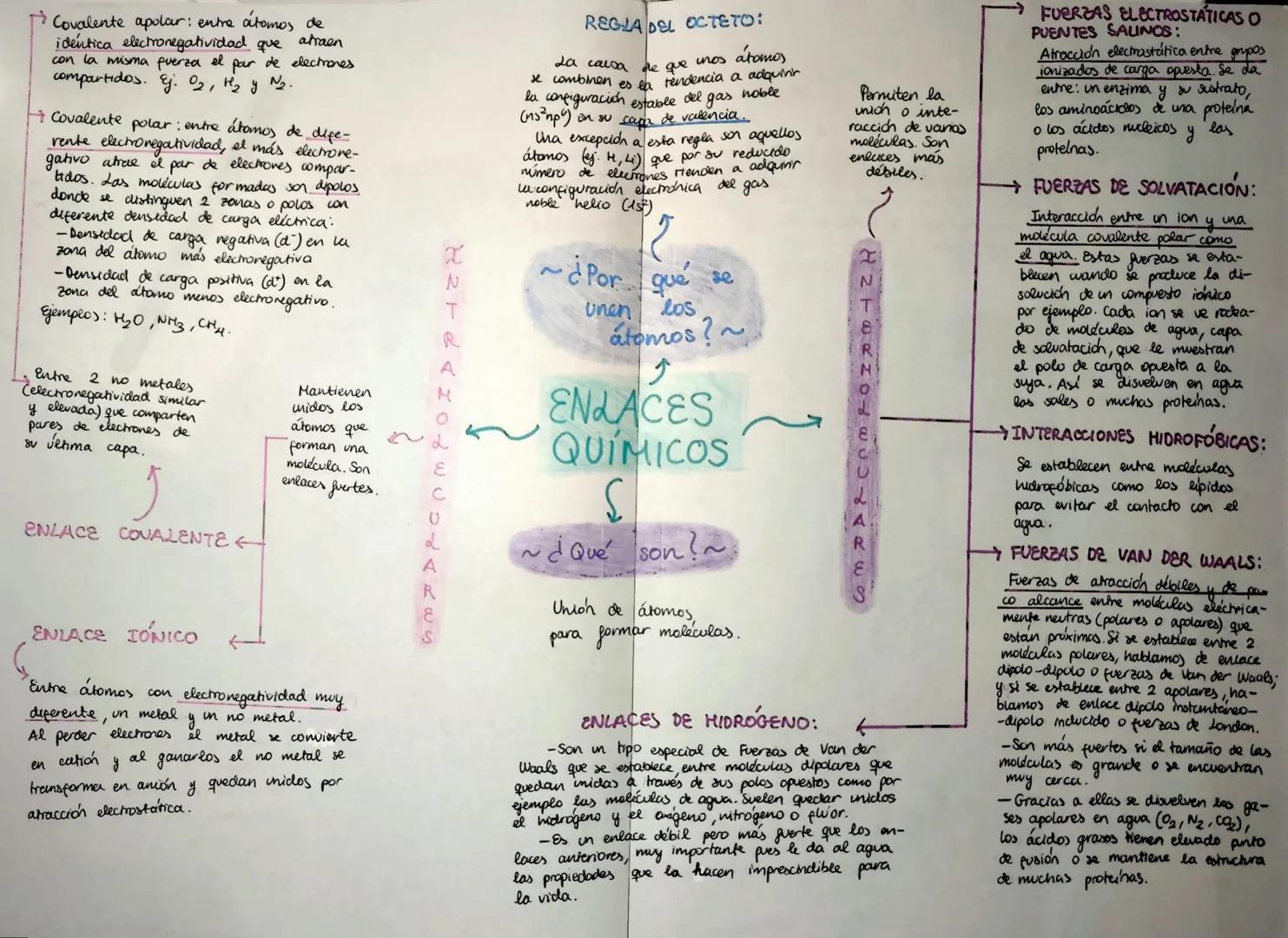
Enlaces Químicos y Fuerzas Intermoleculares
¿Te has preguntado por qué el aceite y el agua no se mezclan? Todo tiene que ver con los enlaces químicos y las fuerzas que actúan entre las moléculas.
Los átomos se unen siguiendo la regla del octeto, que básicamente dice que quieren tener 8 electrones en su capa exterior para ser estables, como los gases nobles. Es como si los átomos buscaran la configuración electrónica más cómoda posible.
Existen dos tipos principales de enlaces fuertes: el enlace iónico (entre metales y no metales, donde uno pierde electrones y el otro los gana) y el enlace covalente (entre no metales que comparten electrones). En el covalente, si los átomos atraen igual los electrones es apolar, pero si uno atrae más fuerte, se forma un dipolo con zonas de carga positiva y negativa.
¡Dato curioso! El hidrógeno es la excepción a la regla del octeto porque solo necesita 2 electrones para ser estable, como el helio.
Además de estos enlaces fuertes, existen fuerzas intermoleculares más débiles pero igualmente importantes. Las fuerzas de Van der Waals actúan entre moléculas neutras cercanas, mientras que los enlaces de hidrógeno son especiales porque conectan moléculas polares a través de sus polos opuestos. Las fuerzas electrostáticas permiten la interacción entre grupos con cargas opuestas, y las interacciones hidrofóbicas hacen que las moléculas "huyan" del agua.
Estas fuerzas débiles son fundamentales para la vida: mantienen la estructura de las proteínas, permiten que las sales se disuelvan en agua, y dan al agua sus propiedades únicas que la hacen imprescindible para todos los seres vivos.