Configuración Electrónica y Sistema Periódico
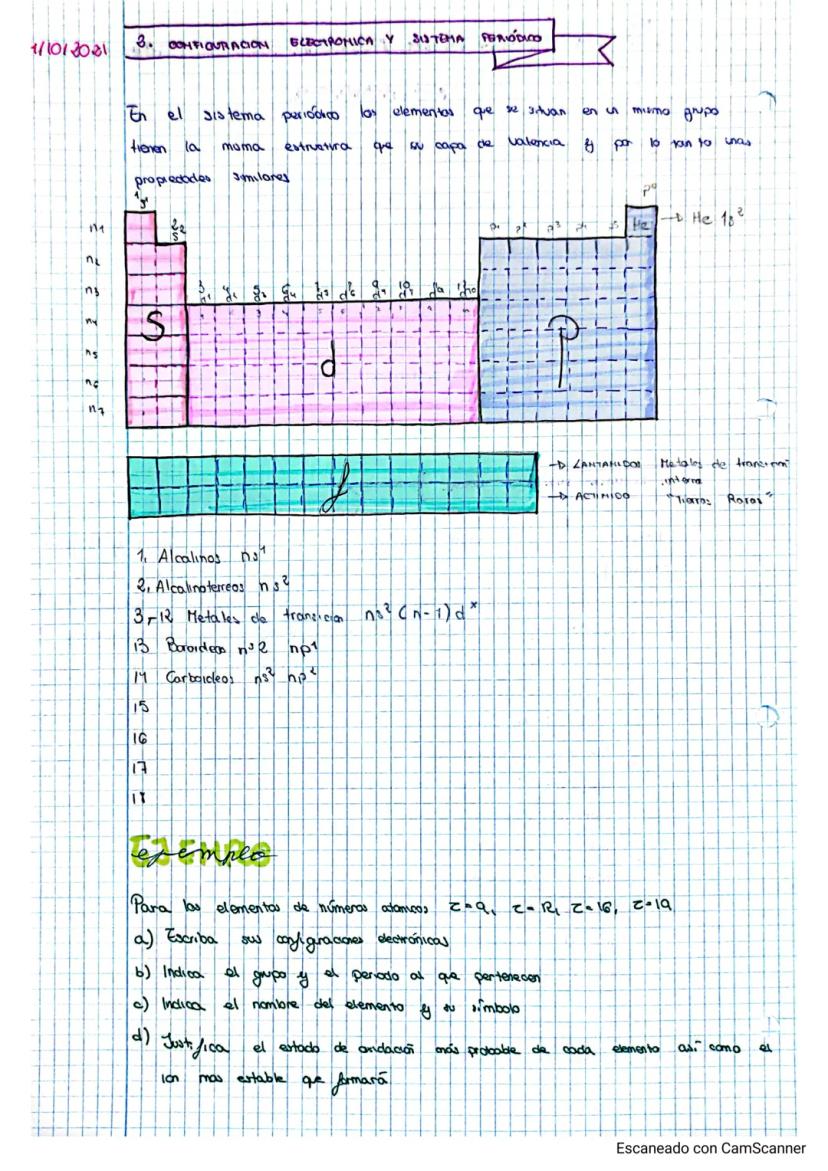
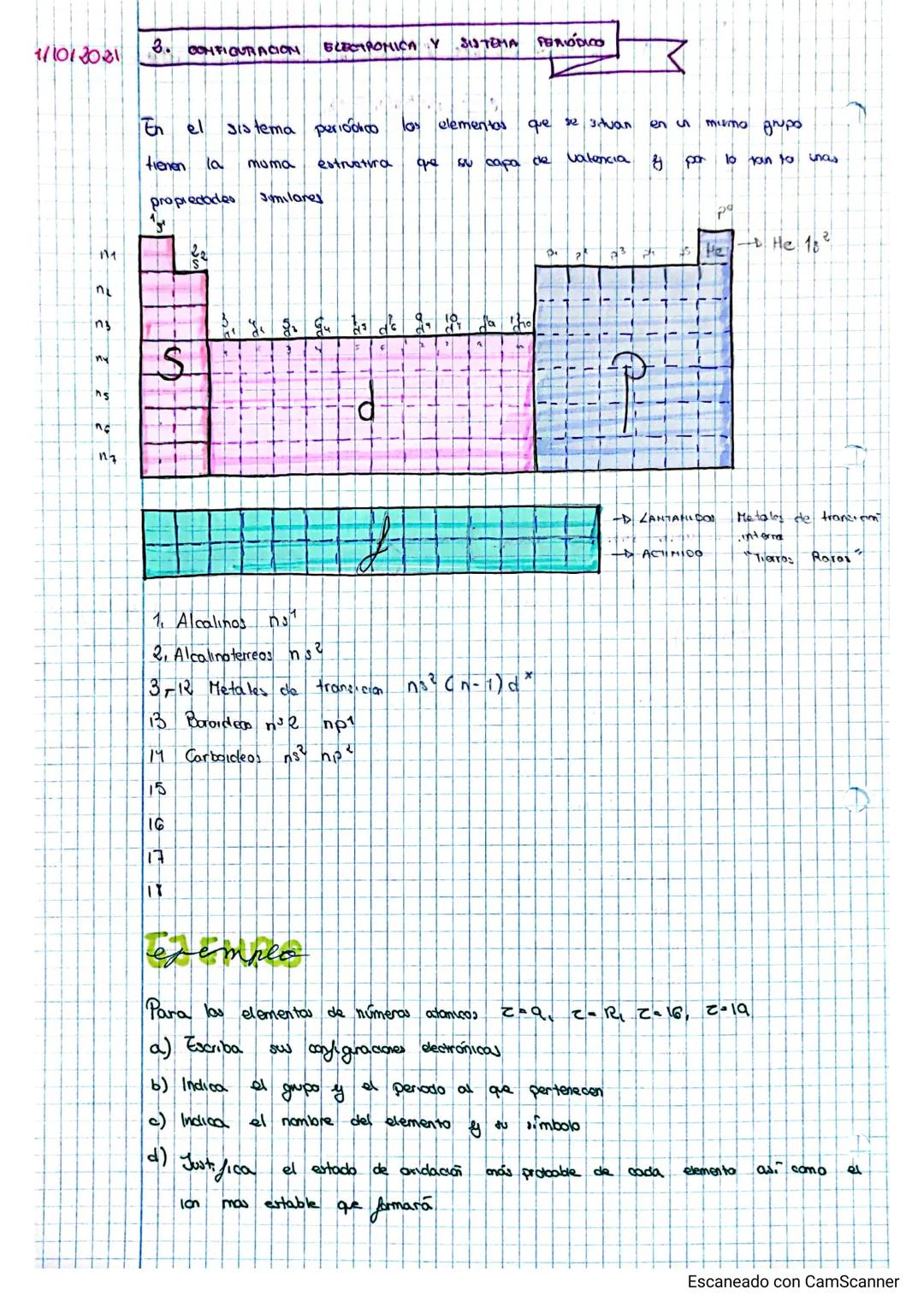
La configuración electrónica es la clave para entender por qué los elementos se comportan como lo hacen. Los elementos del mismo grupo tienen exactamente la misma configuración en su capa de valencia, y por eso actúan de forma similar.
Cada tipo de orbital (s, p, d, f) corresponde a una zona específica de la tabla periódica. Los grupos 1 y 2 terminan en orbitales s, los grupos 13-18 en orbitales p, y los metales de transición en orbitales d.
Para resolver problemas, sigue estos pasos: escribe la configuración electrónica, identifica la capa de valencia, determina el grupo y periodo, y finalmente predice el estado de oxidación más probable. Los elementos tienden a ganar o perder electrones para conseguir configuración de gas noble.
Truco de examen: El periodo siempre coincide con el nivel energético más alto en la configuración electrónica.