Casos Específicos de Polaridad Molecular
En moléculas diatómicas, la polaridad depende solo del enlace. Las homonucleares (O₂, Cl₂) son siempre apolares, mientras que las heteronucleares (HBr, HCl) pueden ser polares.
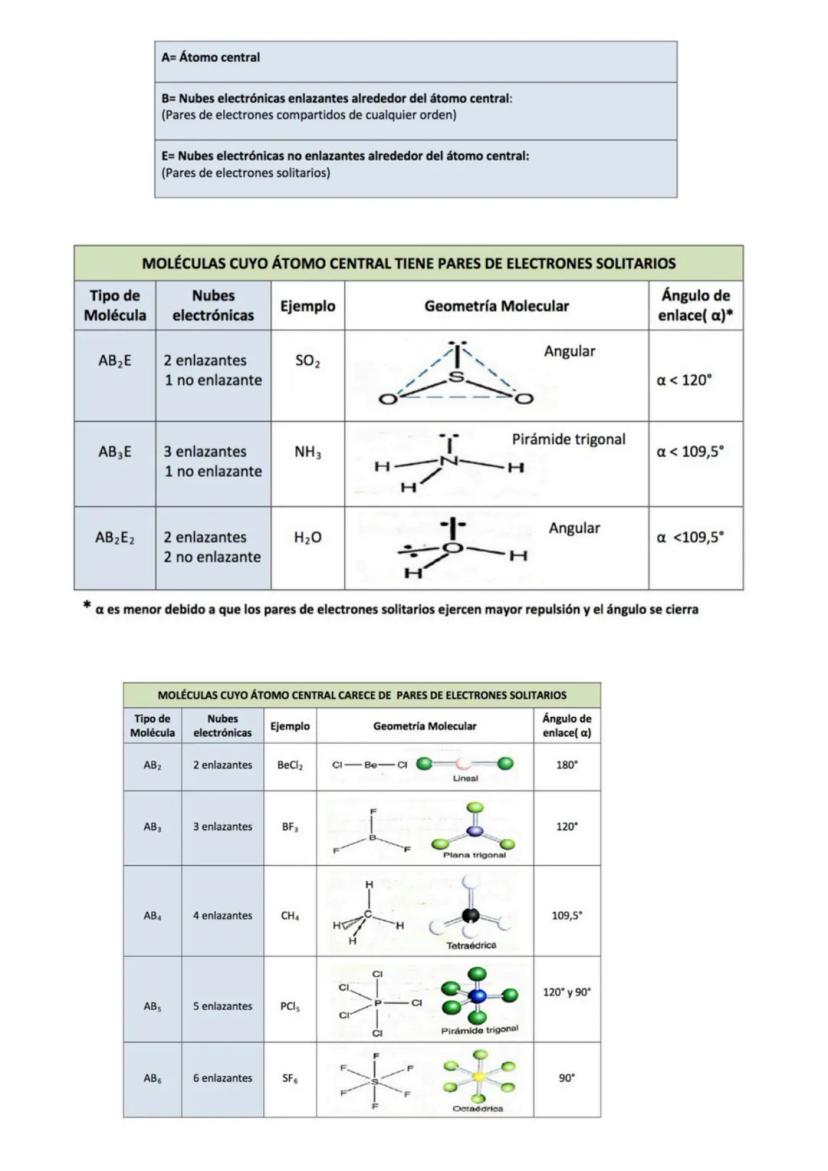
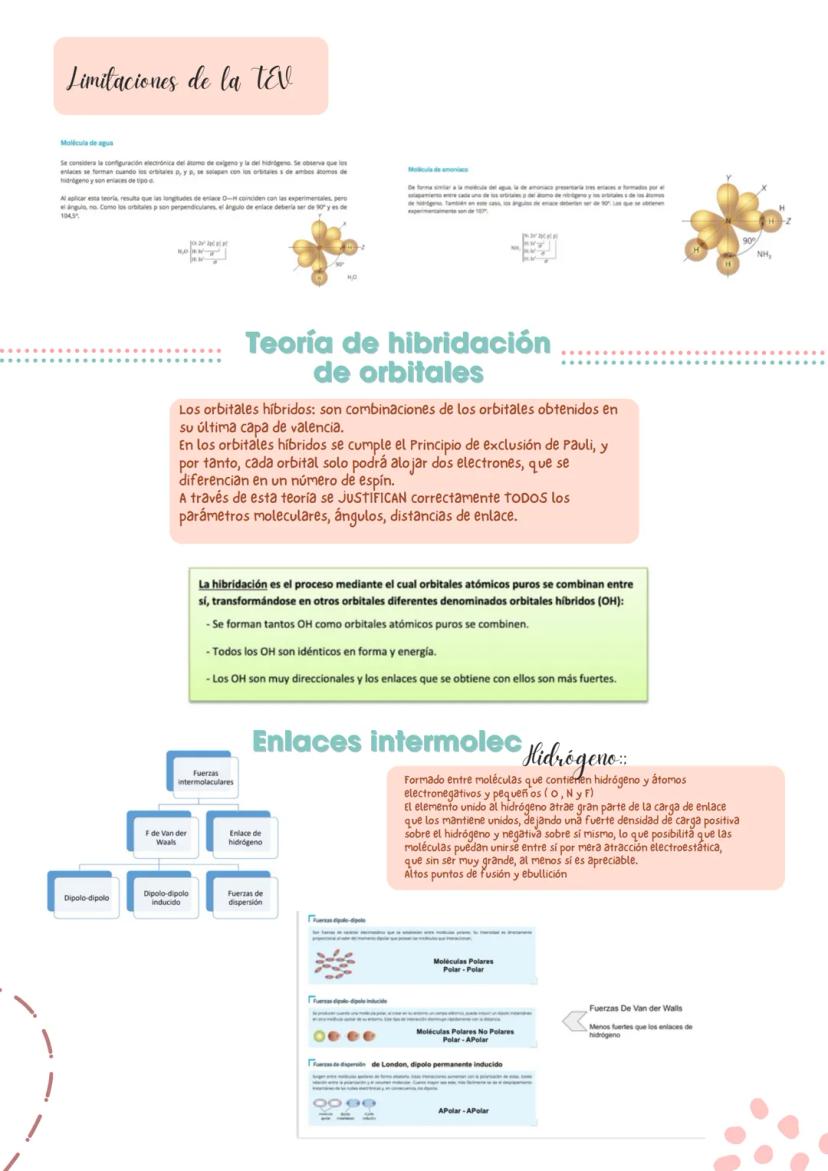
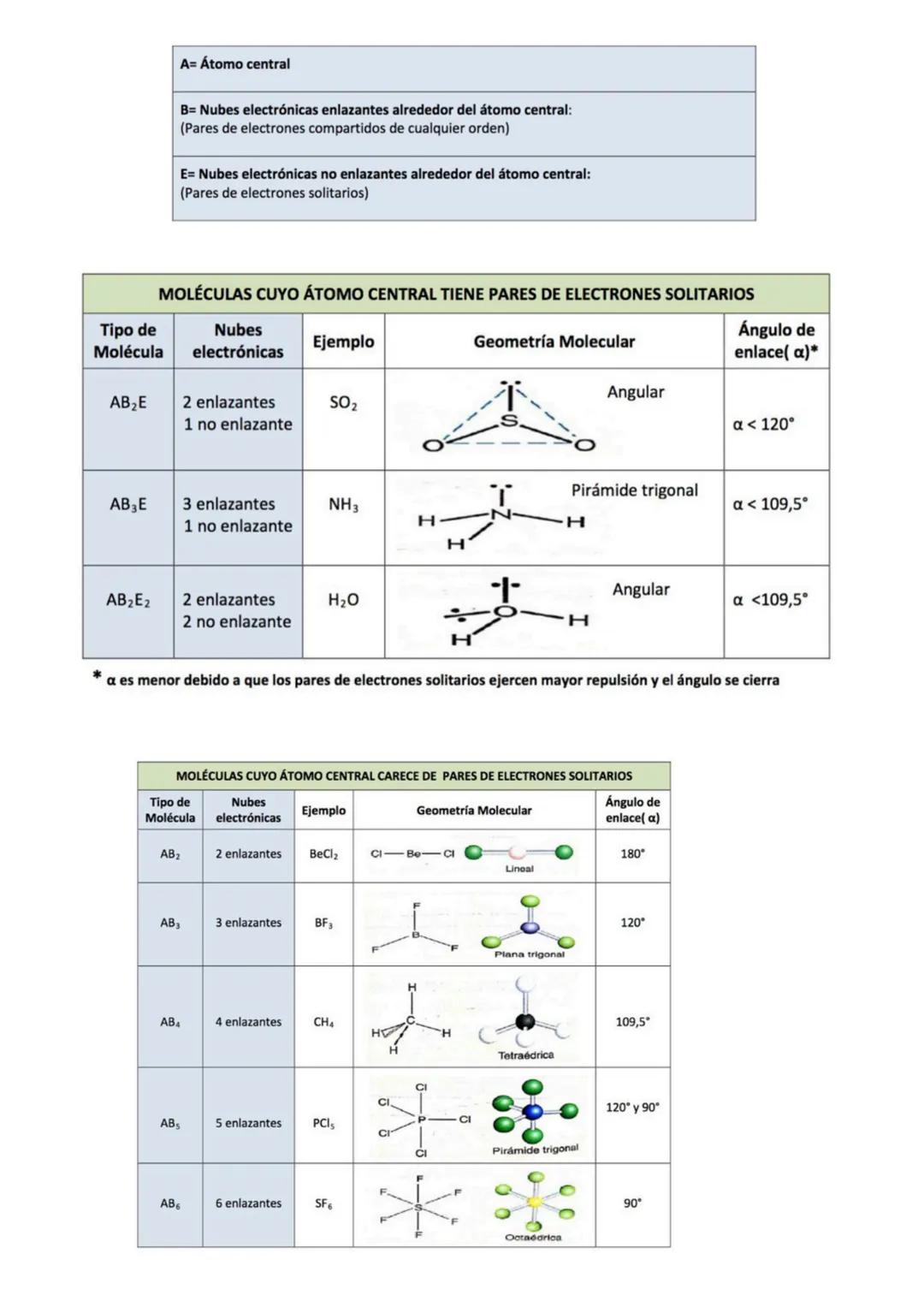
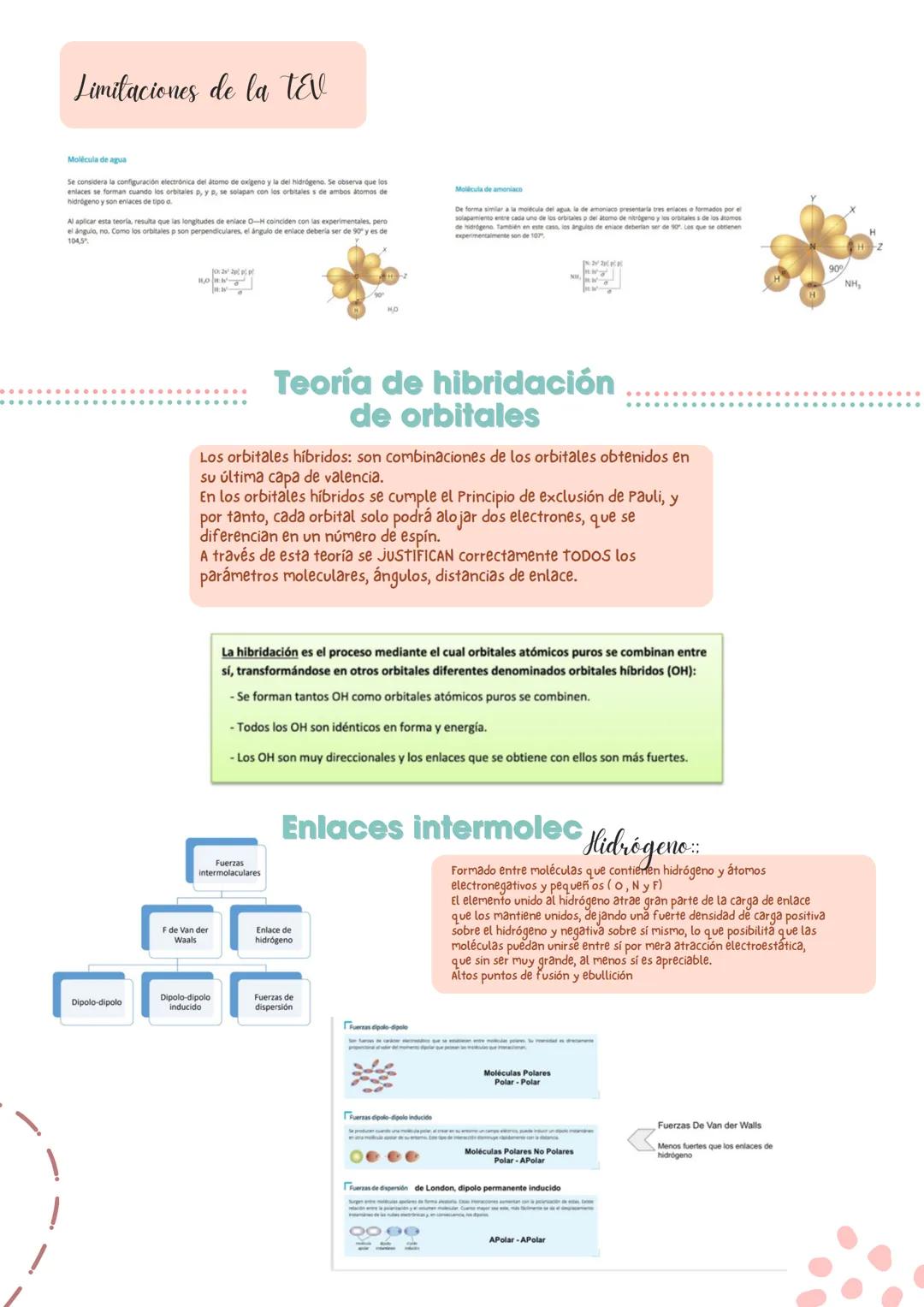
En moléculas más complejas, necesitas considerar tanto la polaridad de los enlaces como la geometría molecular. Los momentos dipolares son vectores, así que se pueden sumar o restar dependiendo de la orientación.
Analiza estos casos típicos: BeCl₂ (lineal, apolar), BF₃ (trigonal plana, apolar), CCl₄ (tetraédrica, apolar), H₂O (angular, polar) y NF₃ (piramidal trigonal, polar). En H₂O y NF₃, los pares libres influyen en la polaridad.
Detalle importante: En NF₃, los pares libres del nitrógeno van en dirección opuesta al vector resultante, reduciendo la polaridad total.