Configuración Electrónica: Donde Viven los Electrones
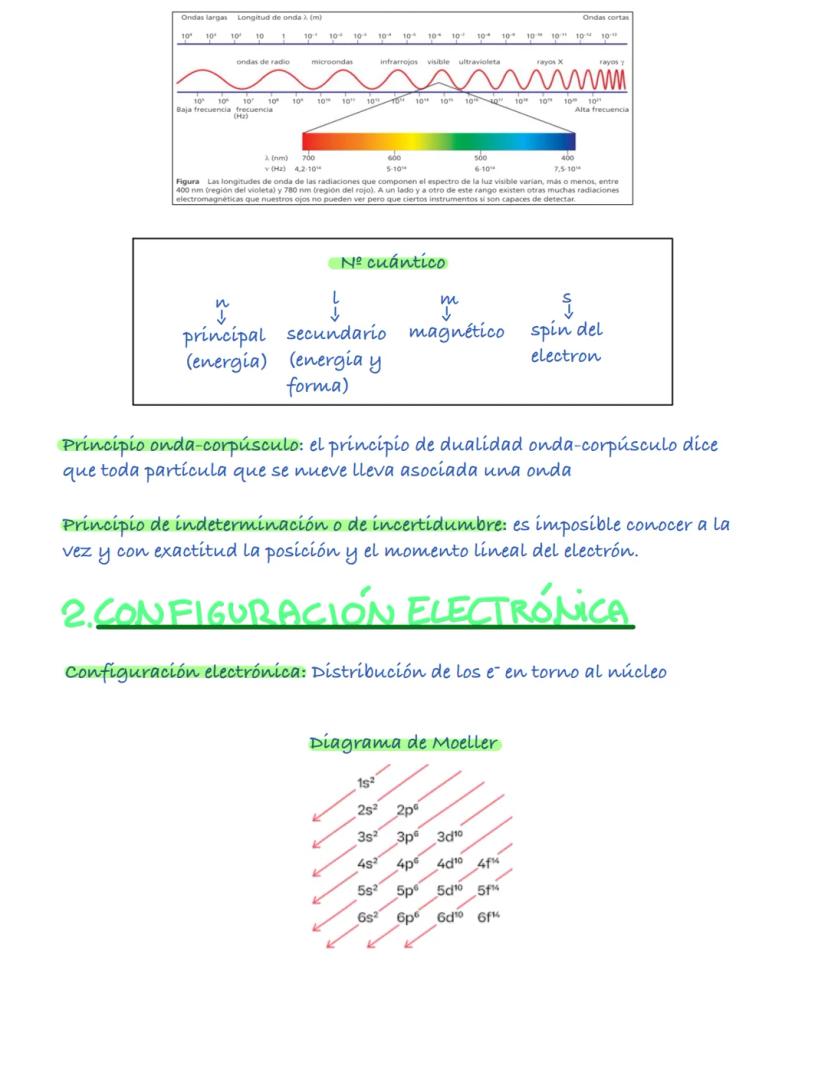
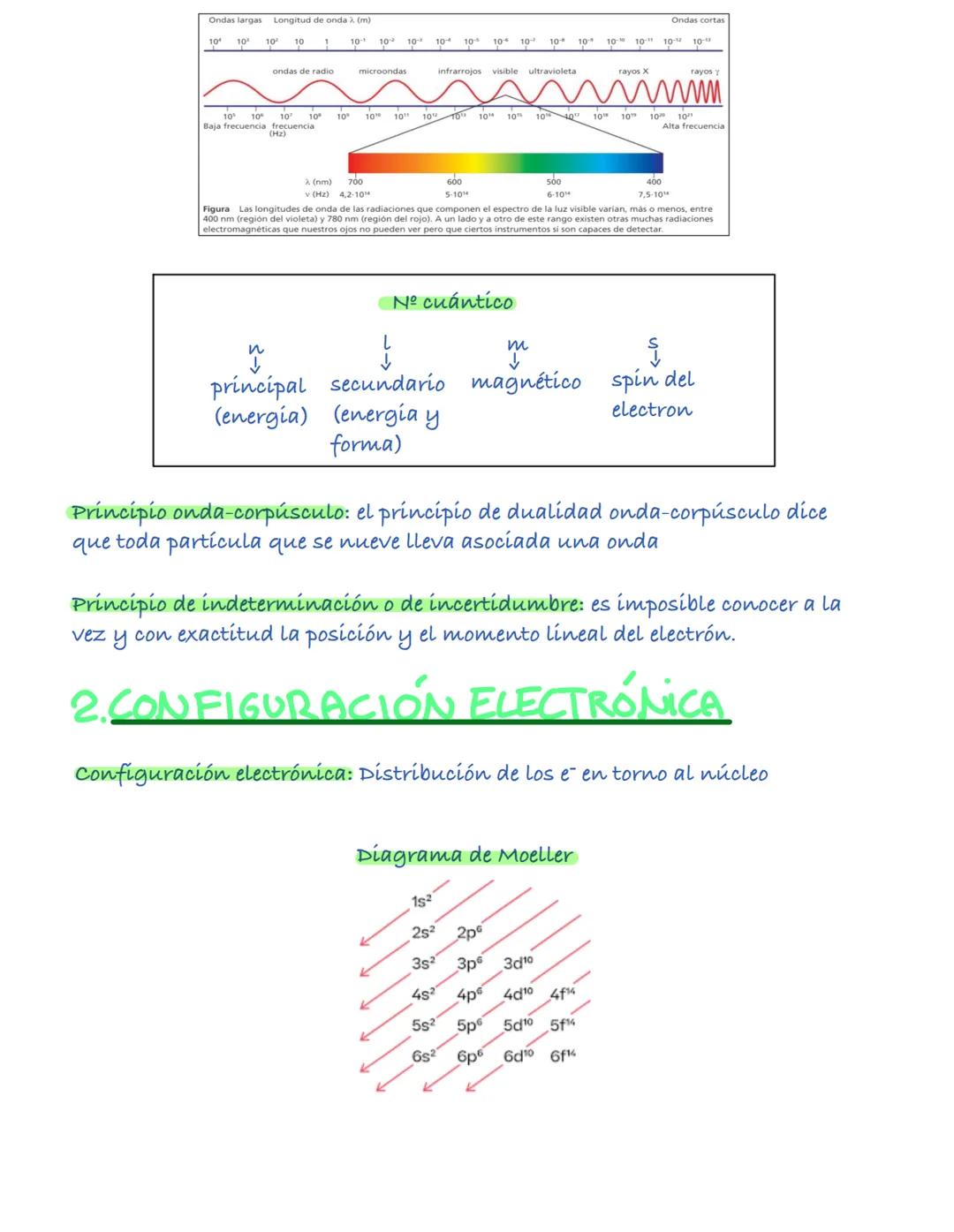
La configuración electrónica te dice cómo se distribuyen los electrones alrededor del núcleo. Es fundamental para entender el comportamiento químico de los elementos.
Los electrones siguen tres reglas básicas: el principio de mínima energía (ocupan primero los orbitales de menor energía), el principio de exclusión de Pauli (máximo dos electrones por orbital con espines opuestos), y la regla de Hund (los electrones prefieren estar solos antes que emparejarse).
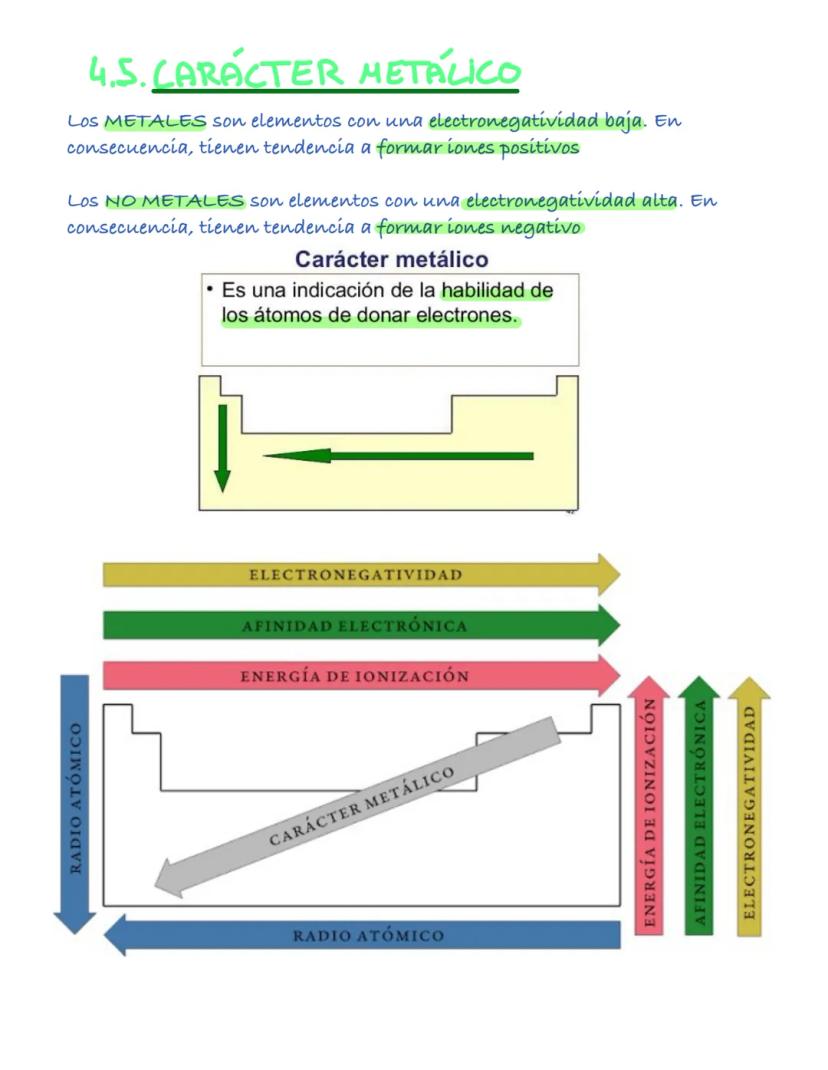
El diagrama de Moeller te ayuda a escribir las configuraciones correctamente: 1s², 2s², 2p⁶, 3s², 3p⁶, etc. Los electrones de valencia son los del último nivel y determinan las propiedades químicas.
💡 Consejo: Usa el diagrama de Moeller como un mapa; nunca te perderás escribiendo configuraciones.