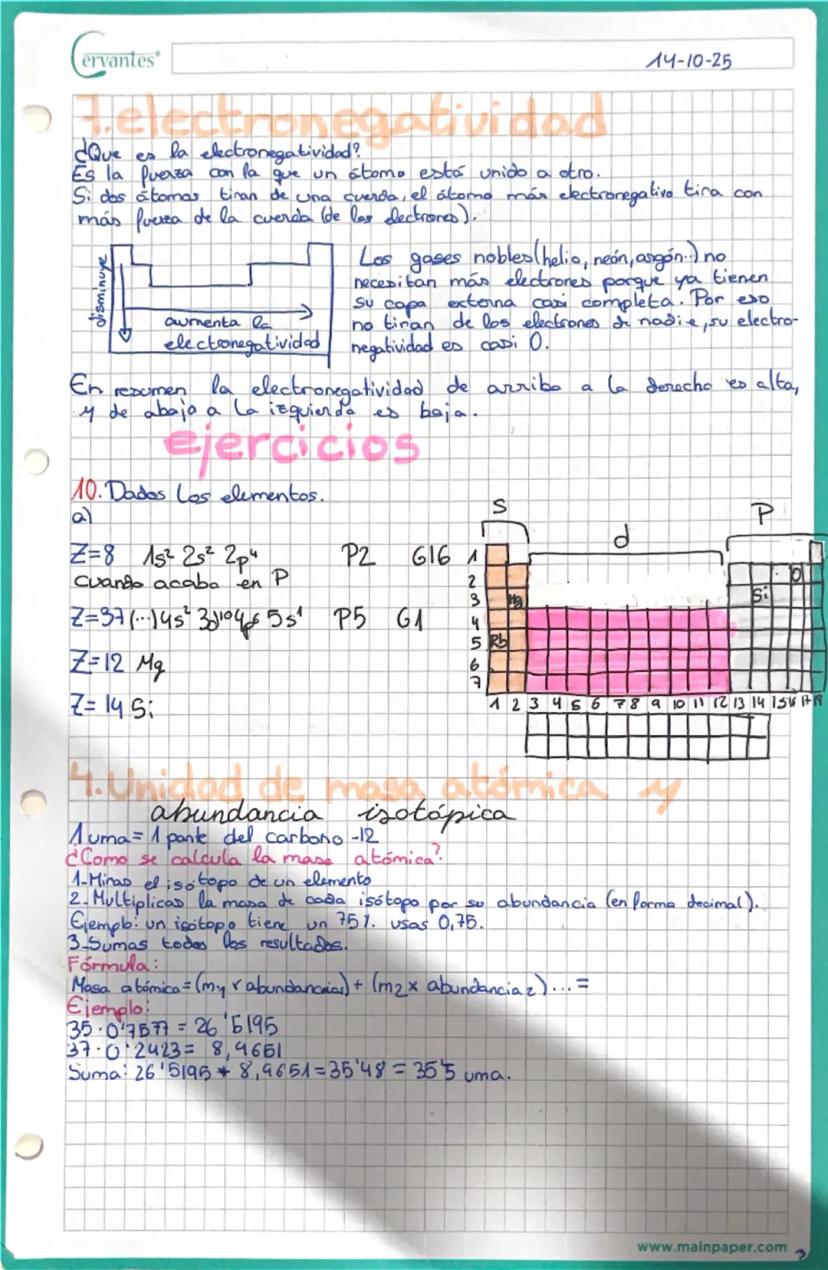
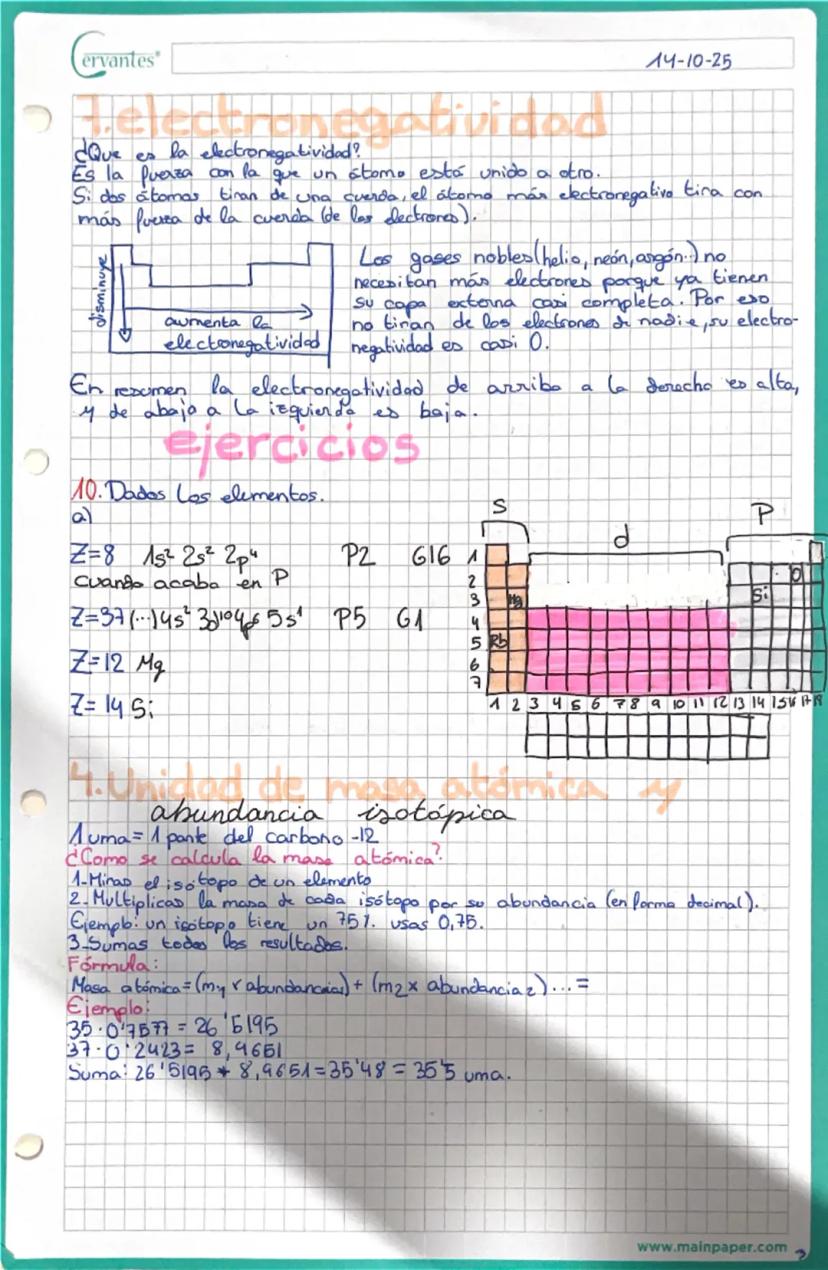
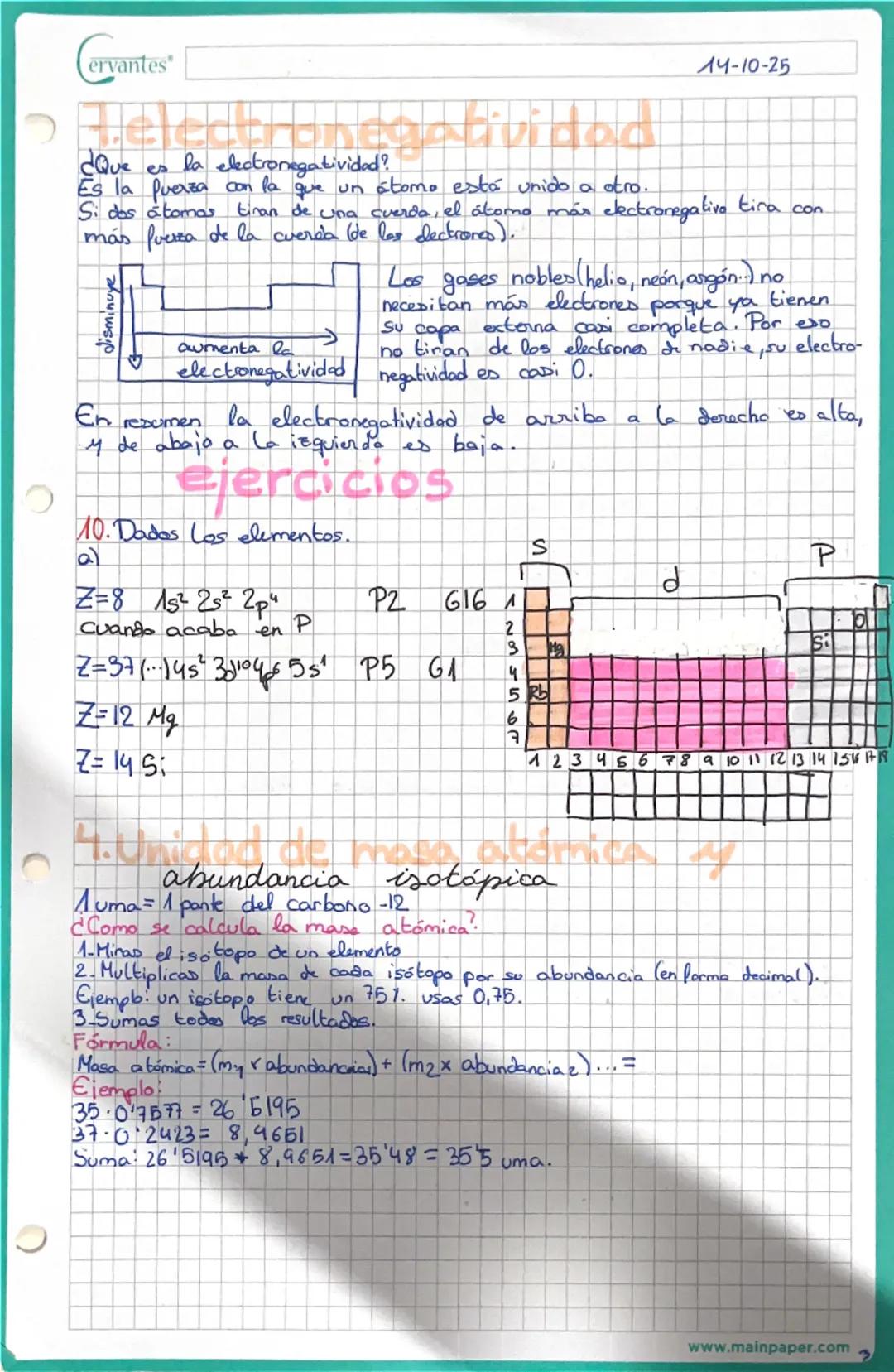
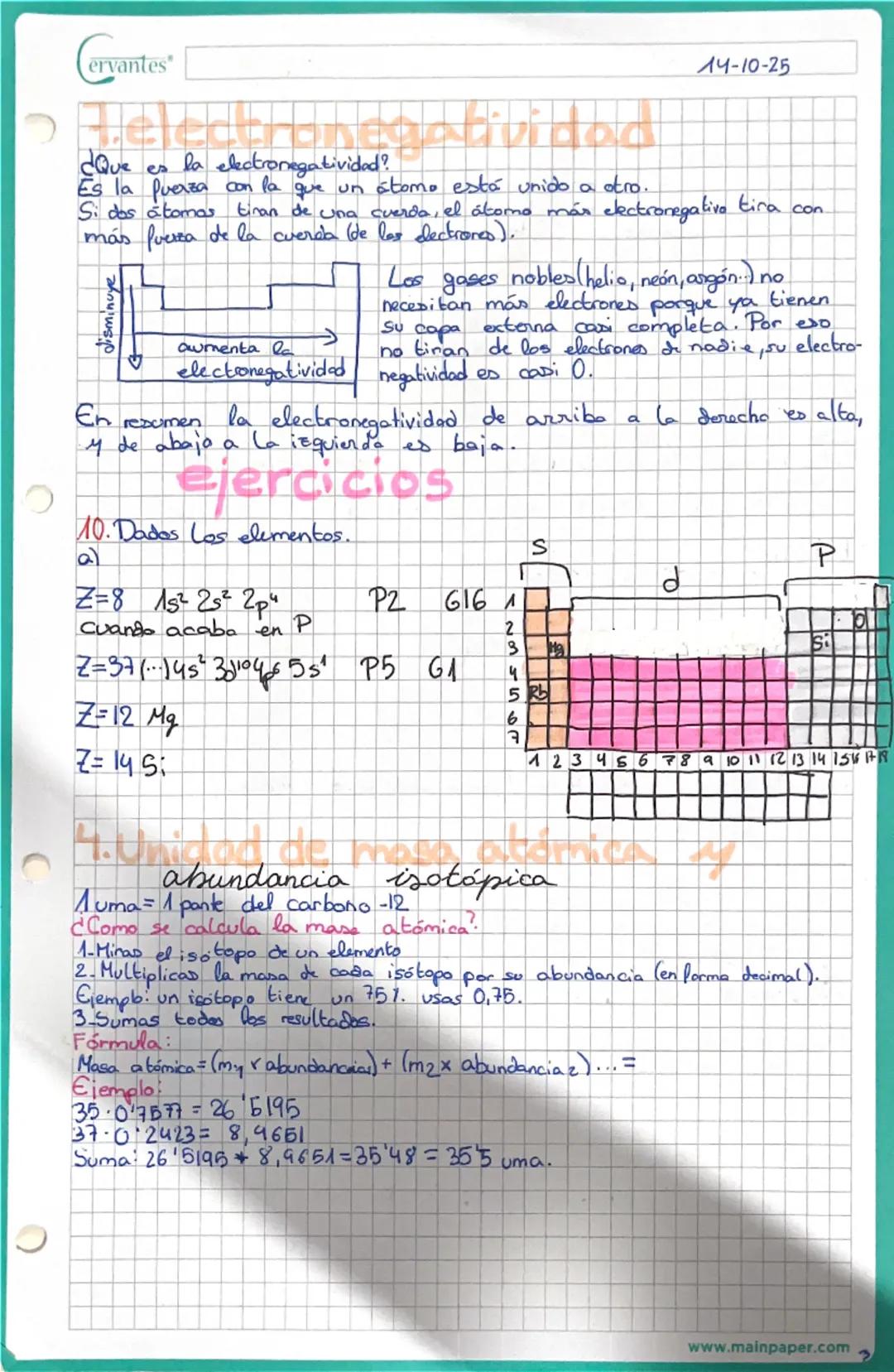
Valencia iónica y formación de iones
La valencia iónica te dice qué carga tendrá un elemento cuando forme un ion. Los metales (como Na, Mg, Ca) tienden a perder electrones y formar cationes positivos. Los no metales (como F, Cl, O) prefieren ganar electrones y formar aniones negativos.
Fíjate en estos patrones: el grupo 1 siempre tiene valencia +1, el grupo 2 tiene +2, el grupo 17 tiene -1, y el grupo 16 tiene -2. Es como si cada grupo tuviera su "personalidad" química.
Para predecir la valencia, cuenta cuántos electrones debe ganar o perder el átomo para tener 8 electrones en su capa externa (regla del octeto). El flúor necesita 1 electrón más, por eso F⁻¹.
💡 Truco para exámenes: Los elementos del mismo grupo tienen la misma valencia porque tienen el mismo número de electrones de valencia.