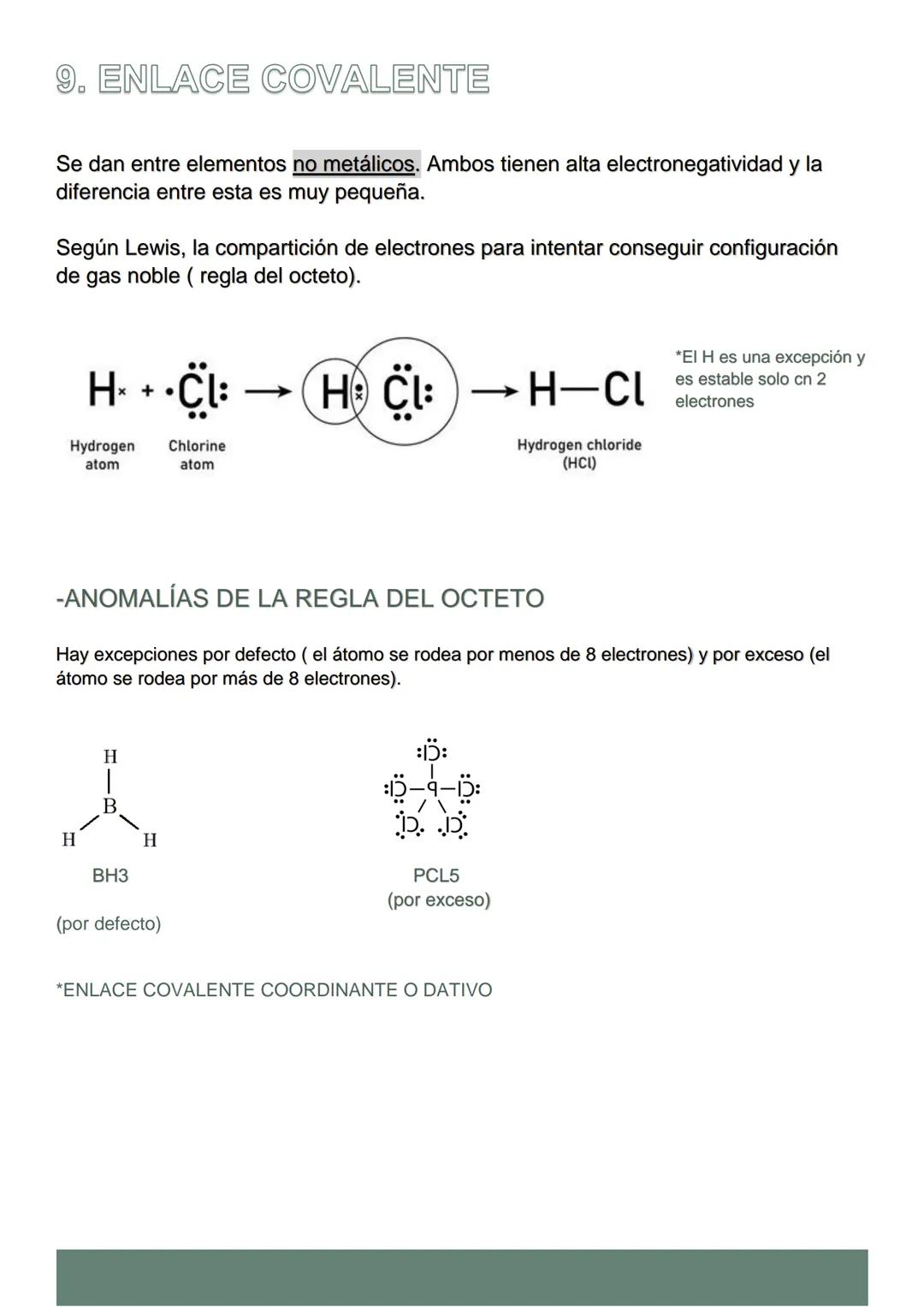
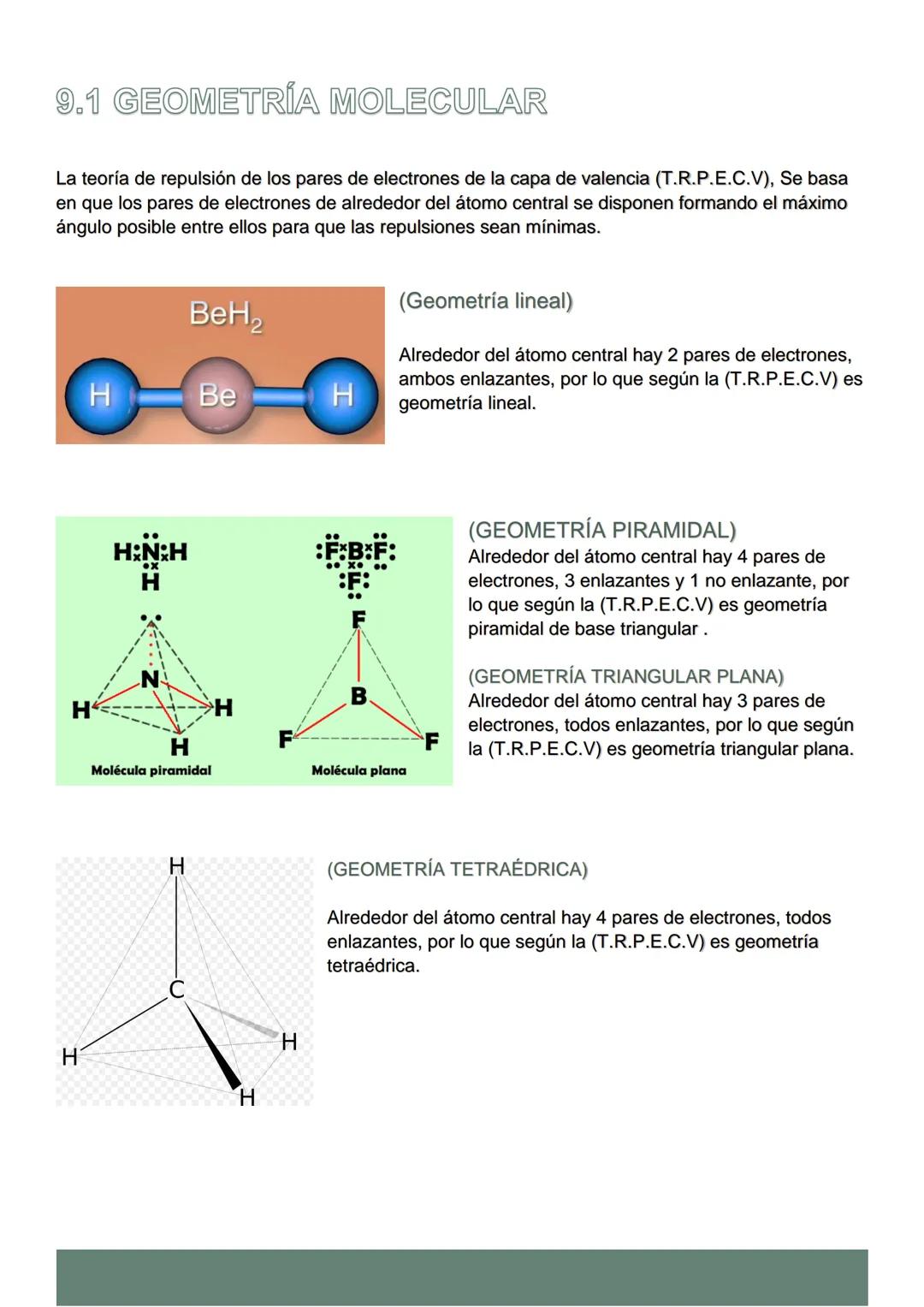
Configuración Electrónica y el Sistema Periódico
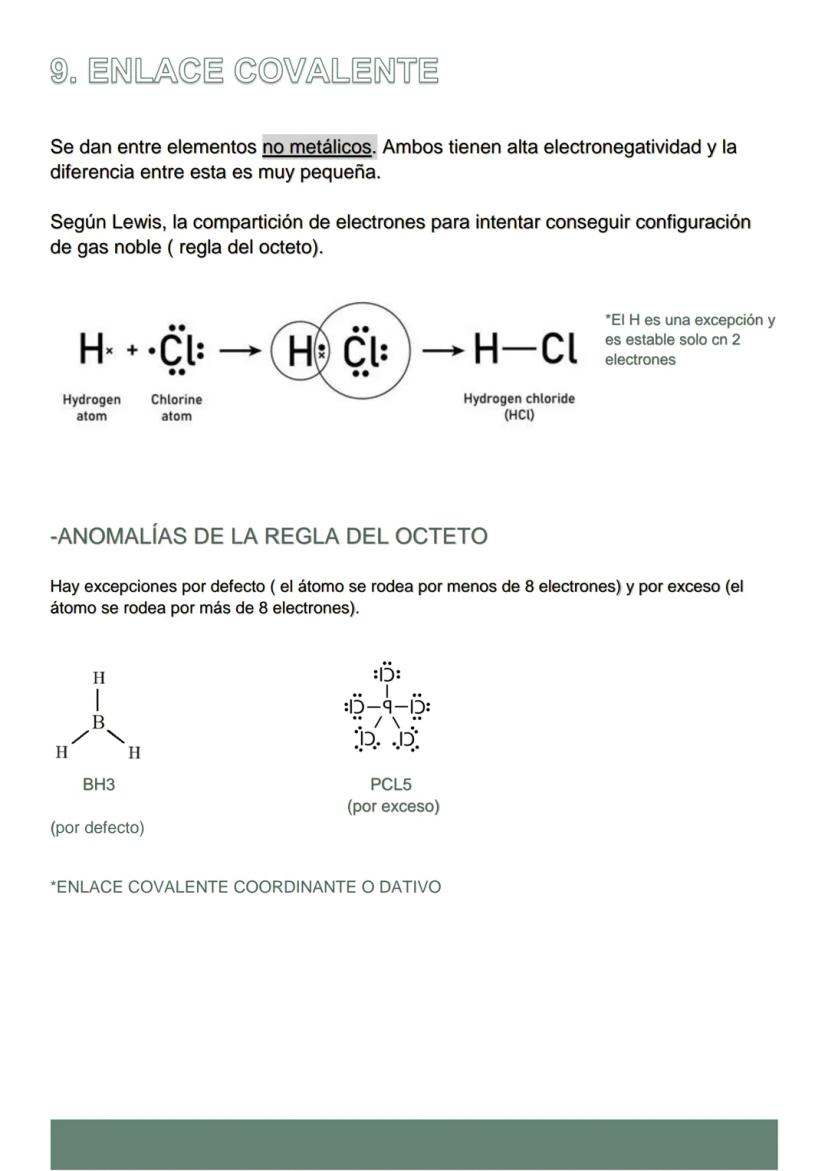
La configuración electrónica es como el plano de un edificio que muestra dónde vive cada electrón. Los electrones son un poco perezosos: siempre ocupan primero los lugares con menos energía siguiendo el principio de Aufbau.
El truco está en la regla n+l: los orbitales se llenan en orden creciente de n+l. Por ejemplo, el 2p n=2,l=1,entoncesn+l=3 se llena después del 3s n=3,l=0,entoncesn+l=3 porque cuando hay empate, gana el de menor n.
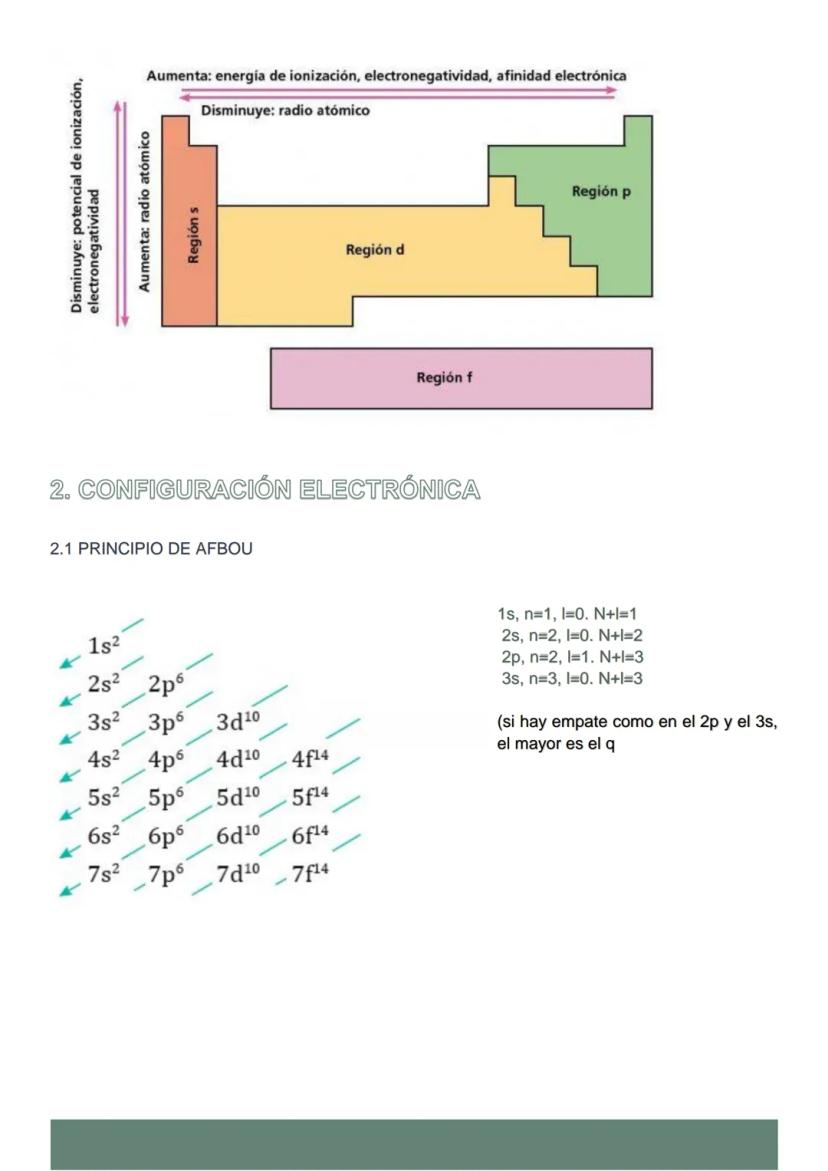
En la tabla periódica, las propiedades periódicas siguen patrones súper útiles. De izquierda a derecha aumentan la energía de ionización y la electronegatividad, pero disminuye el tamaño atómico. De arriba hacia abajo es justo lo contrario.
💡 Tip de examen: Dibuja flechas en tu tabla periódica para recordar hacia dónde aumenta cada propiedad.