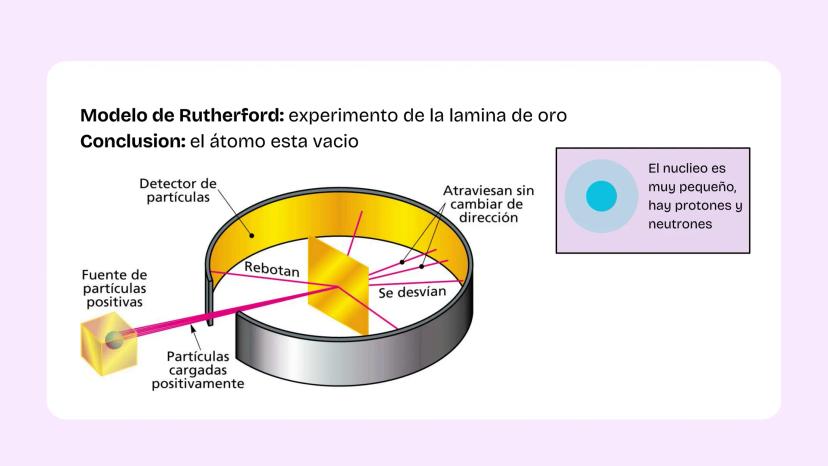
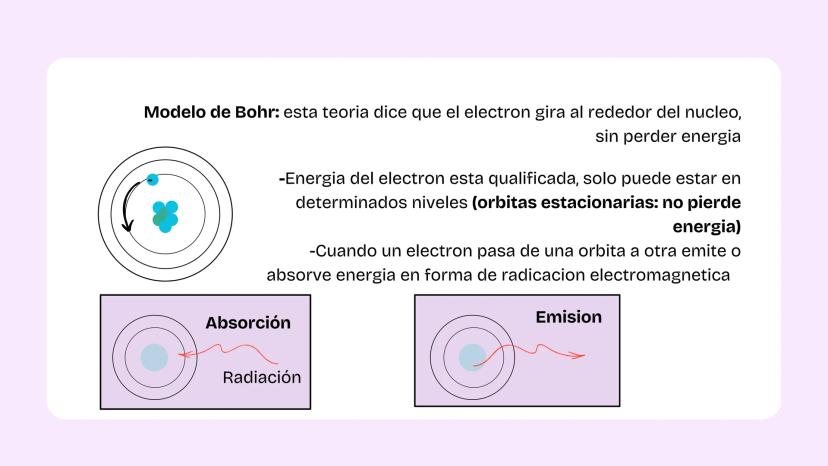
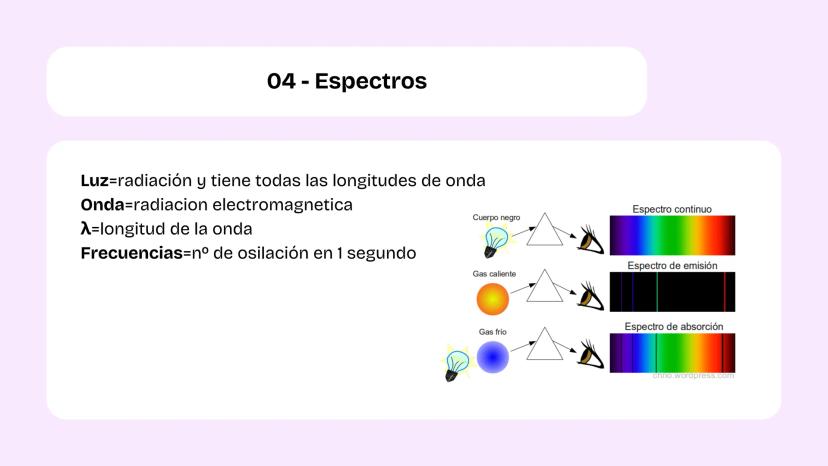
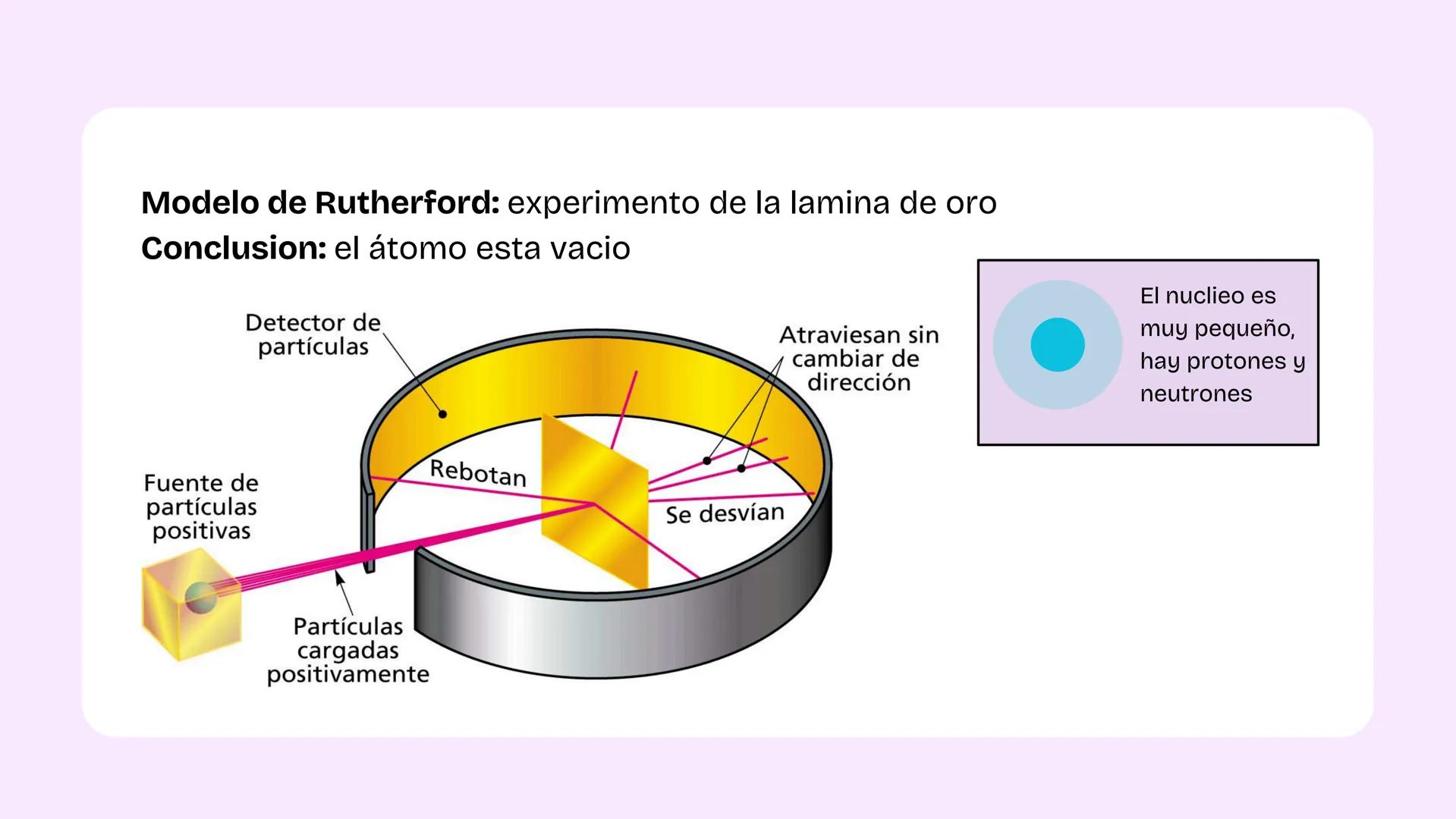
Configuración Electrónica
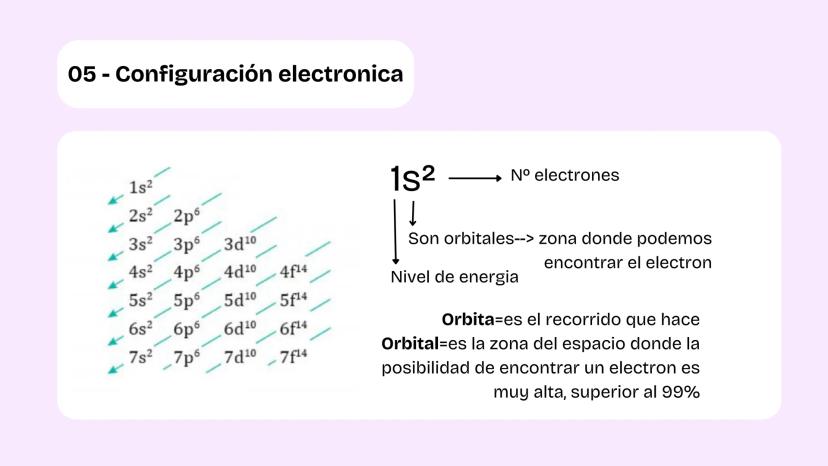
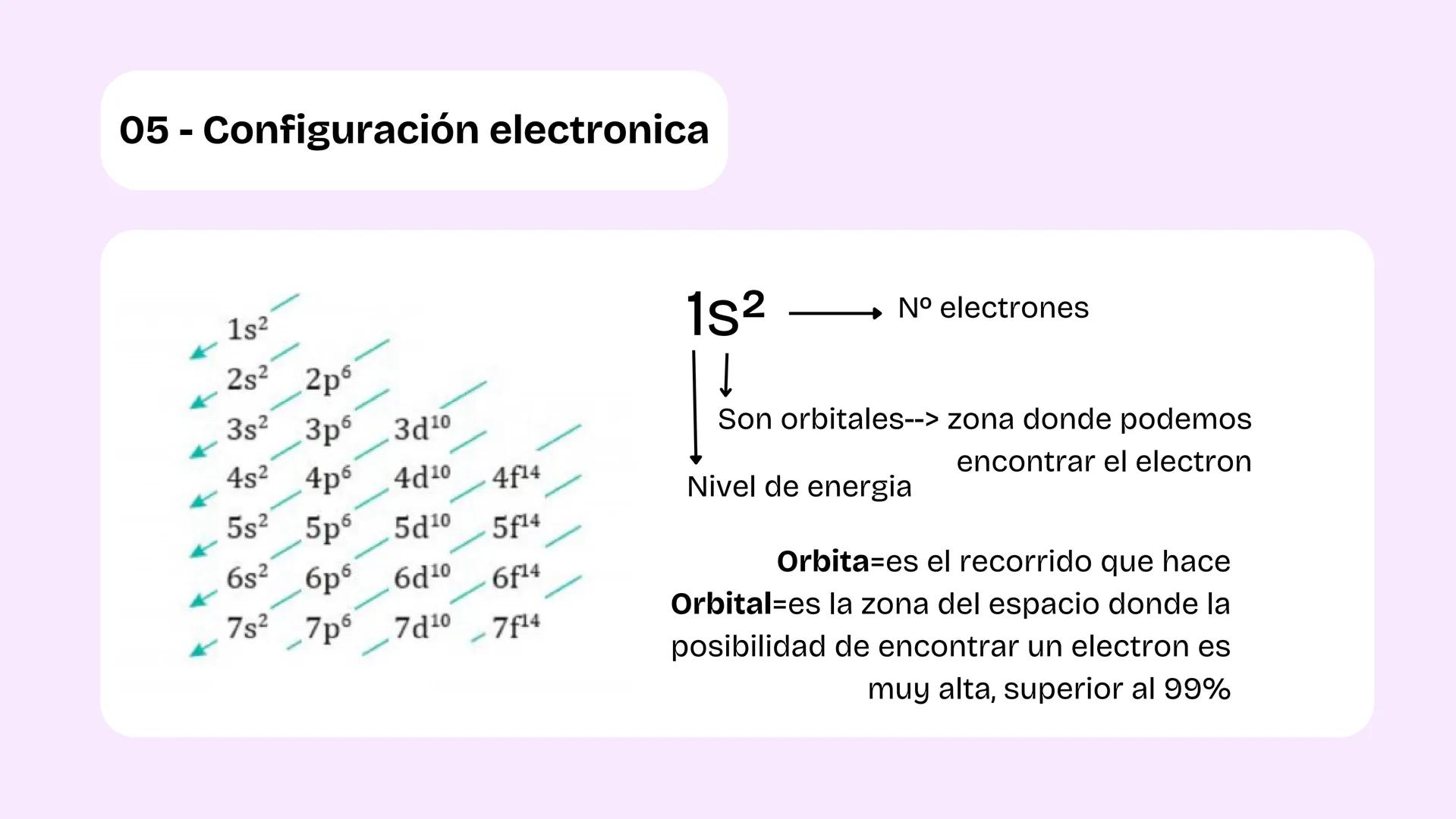
La configuración electrónica te dice exactamente dónde están los electrones en un átomo. Los electrones se organizan en niveles de energía y orbitales, que son zonas donde hay más del 99% de probabilidad de encontrar un electrón.
La diferencia clave: una órbita es un recorrido fijo (como en el modelo de Bohr), pero un orbital es una región del espacio donde probablemente está el electrón. Es más como una nube de probabilidad que una ruta específica.
Para escribir configuraciones electrónicas, sigues el orden: 1s², 2s², 2p⁶, 3s², 3p⁶, etc. Los números indican el nivel de energía, las letras el tipo de orbital, y los exponentes cuántos electrones hay.
Tip de estudio: Practica con los primeros 20 elementos - son los que más aparecen en exámenes y te ayudan a entender los patrones.