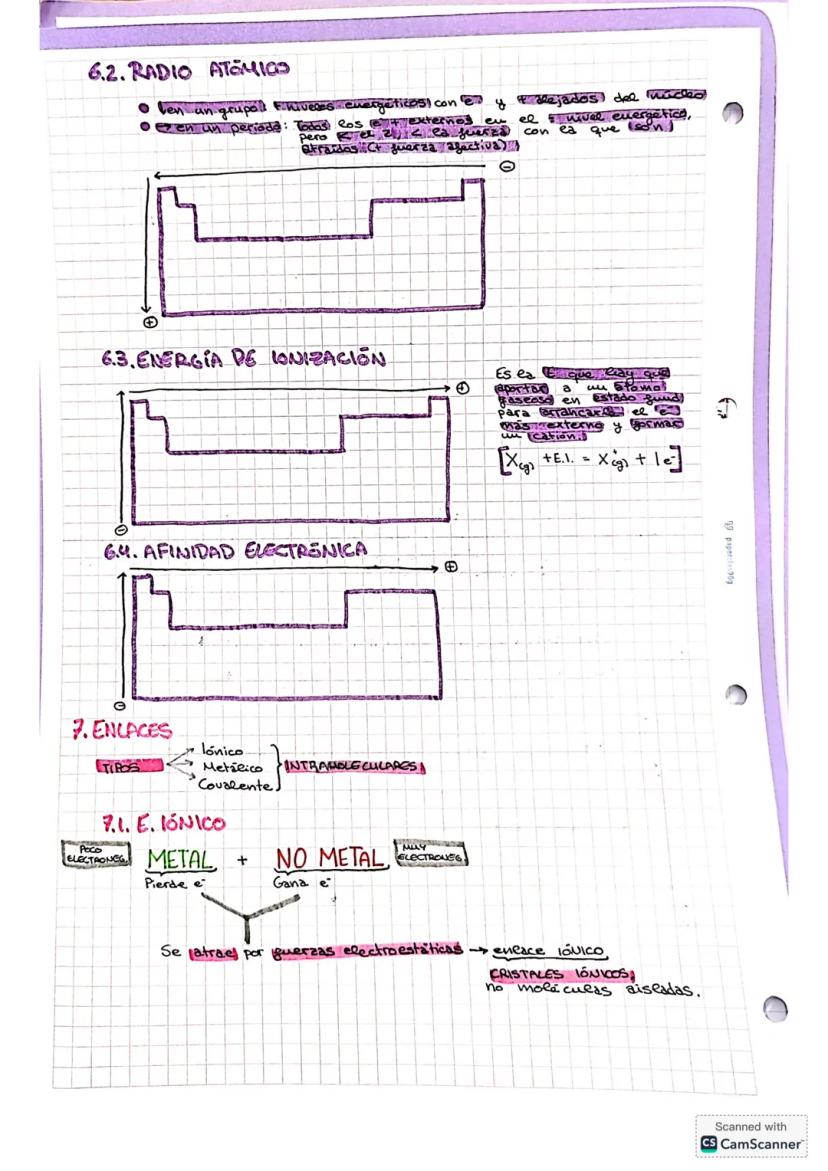
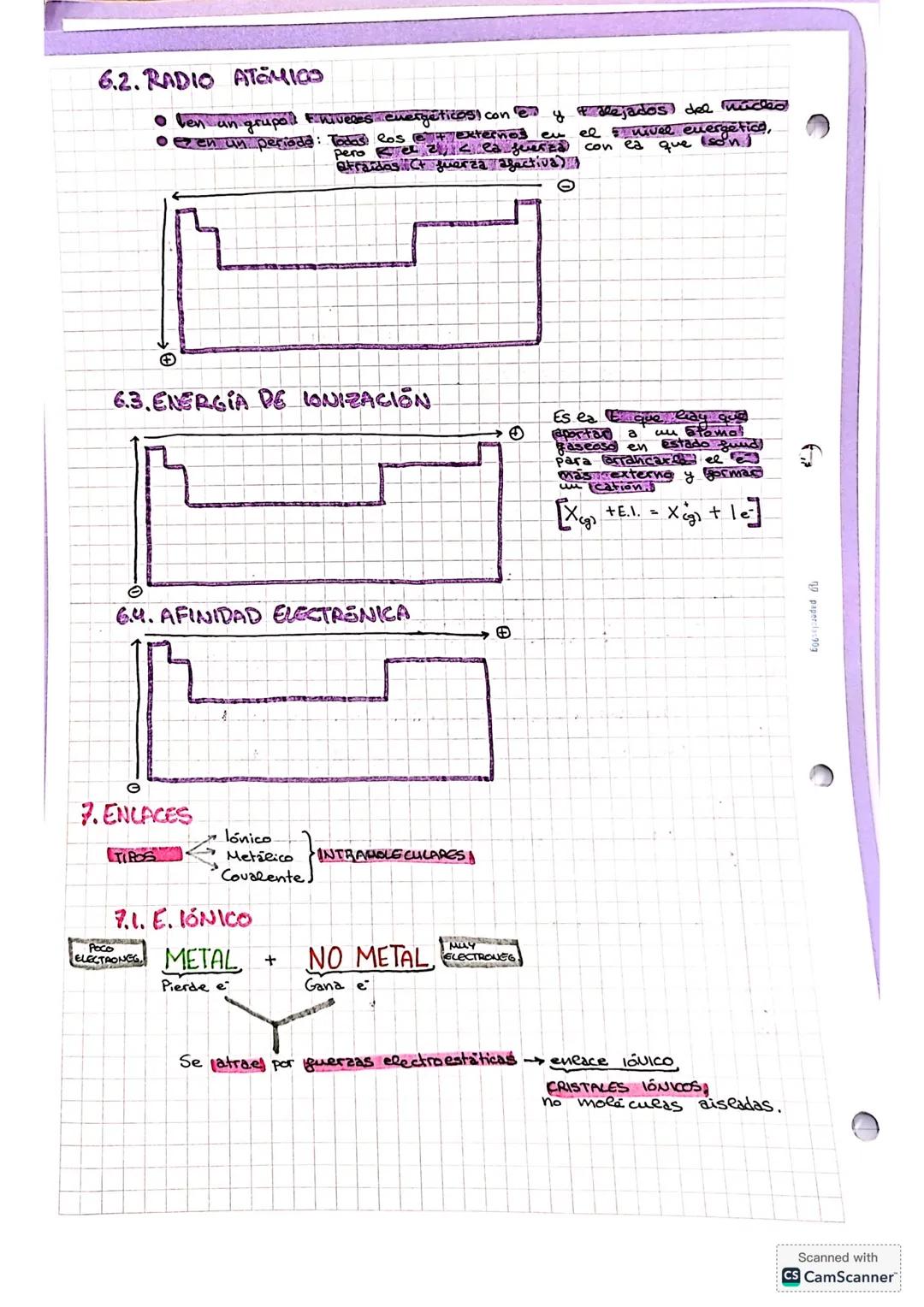
Espectros de Absorción y Números Cuánticos
Los espectros de absorción aparecen cuando un elemento absorbe solo ciertas radiaciones electromagnéticas específicas, creando rayas negras características. Es como la "huella dactilar" de cada elemento.
La ecuación de Rydberg nos permite calcular dónde aparecen estas rayas: χ = RH 1/n12−1/n22. La constante de Rydberg vale 1.097.410 m⁻¹, y esta fórmula relaciona los cambios de energía con los saltos de electrones entre niveles.
Los números cuánticos son como la dirección completa de cada electrón:
- n (principal): el "piso" o nivel de energía donde vive el electrón
- l (secundario): la "forma del apartamento" s=esfeˊrica,p=bilobular,d,f
- ml (magnético): la orientación en el espacio
- ms (espín): el sentido de rotación del electrón (±1/2)
¡Recuerda! El principio de exclusión de Pauli dice que no pueden existir dos electrones con los mismos cuatro números cuánticos. Es como si cada electrón necesitara su propia "dirección única".
Para las configuraciones electrónicas, usa el diagrama de Moeller: los electrones siempre ocupan primero los orbitales de menor energía disponibles, como llenar una escalera desde abajo.