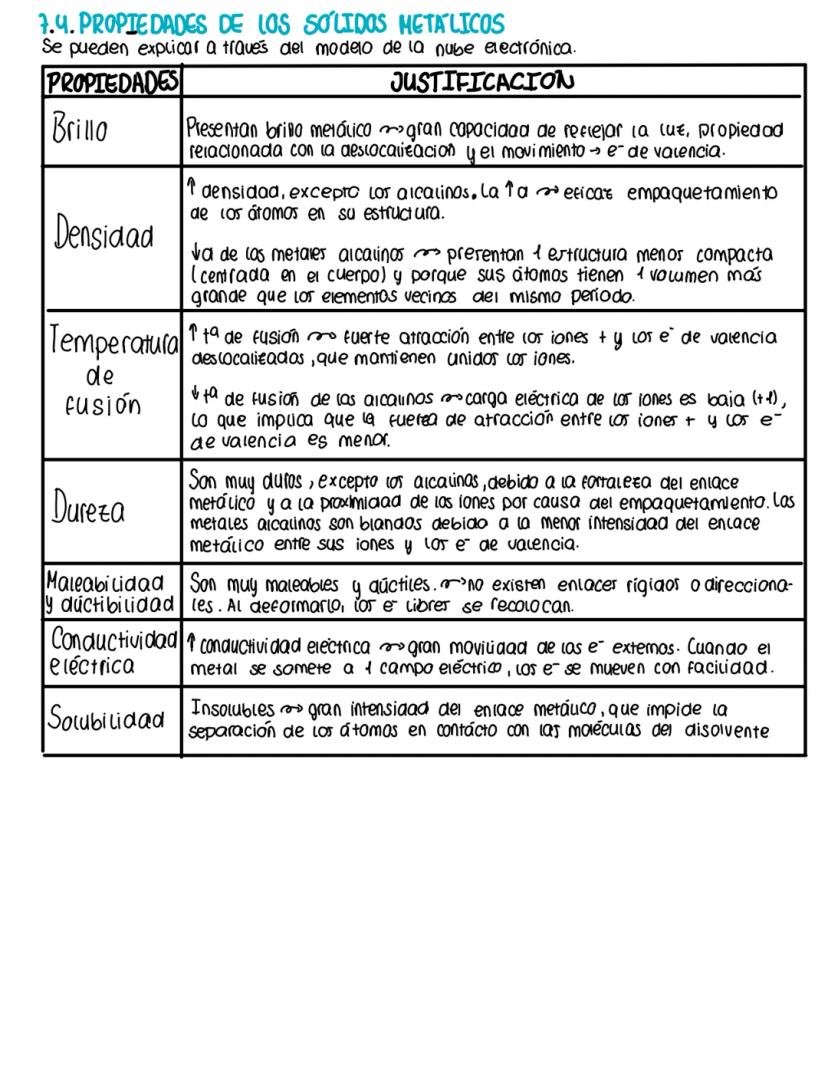
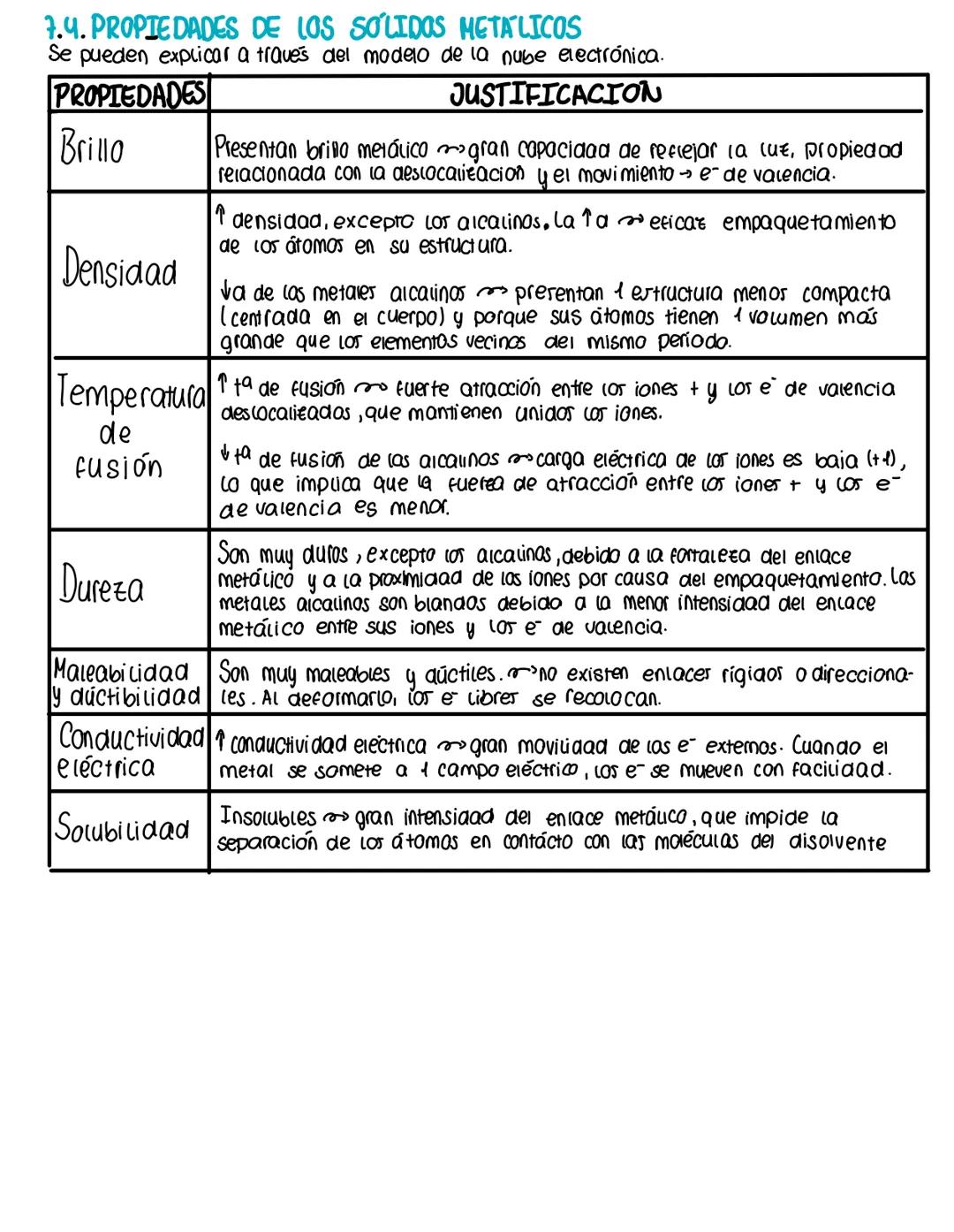
El enlace covalente: compartiendo electrones
Gilbert Lewis descubrió algo fascinante: los gases nobles son súper estables porque tienen su última capa de electrones completa. Los demás átomos "quieren" ser como ellos, y para conseguirlo comparten electrones.
Cuando dos átomos se acercan, ocurren varias cosas a la vez. Al principio se atraen (la energía potencial disminuye), pero si se acercan demasiado se repelen violentamente. Existe una distancia perfecta donde la energía es mínima y se forma el enlace.
Lewis creó un sistema genial para representar esto: escribes el símbolo del elemento y dibujas puntos alrededor para mostrar sus electrones de valencia. Cuando dos átomos comparten electrones, los unes con una línea. Por ejemplo, dos hidrógenos se unen compartiendo sus electrones: H-H.
La regla del octeto dice que los átomos quieren tener 8 electrones en su última capa (o 2 si es la primera). Esto explica por qué el oxígeno forma dos enlaces en el agua H−O−H y el nitrógeno tres en el amoníaco.
💡 Truco para exámenes: Para saber cuántos enlaces puede formar un átomo, cuenta cuántos electrones le faltan para completar su octeto.