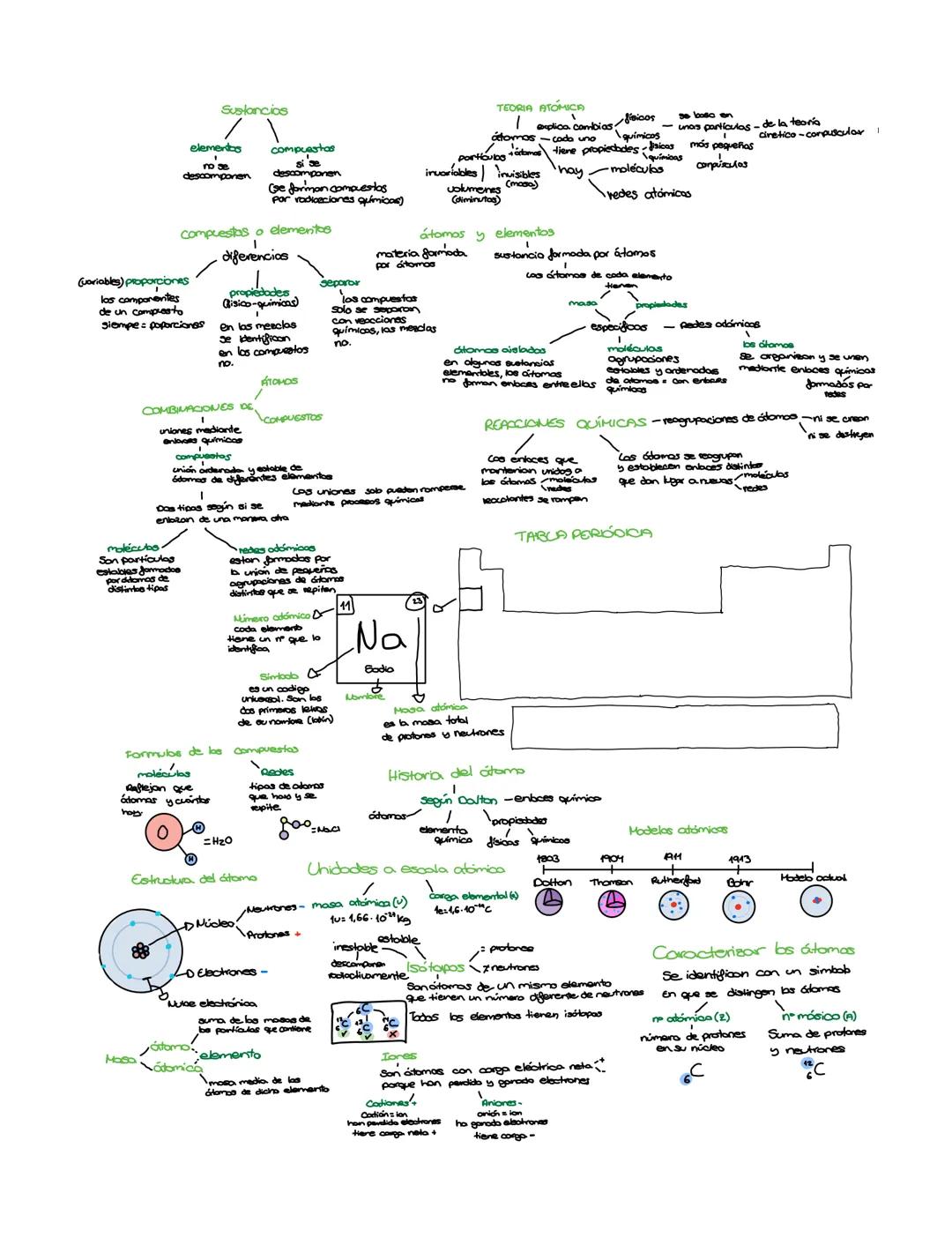
Sustancias: Elementos y Compuestos
Imagínate que la materia es como un gigantesco juego de construcción donde las piezas básicas son los elementos. Estos elementos no se pueden descomponer en nada más simple, son como las piezas fundamentales del universo.
Los compuestos, por el contrario, son como estructuras que construyes uniendo varias piezas diferentes. Se pueden descomponer mediante reacciones químicas para separar los elementos que los forman.
La diferencia principal está en cómo se comportan: en las mezclas puedes identificar cada componente por separado (como cuando ves los trozos de fruta en un yogur), pero en los compuestos no puedes distinguir los elementos originales.
¡Dato curioso! El agua (H₂O) es un compuesto que solo se puede separar en hidrógeno y oxígeno mediante reacciones químicas, no por métodos físicos como filtrar o hervir.
Combinaciones de Átomos: Moléculas y Redes
Los átomos no suelen vivir solos, prefieren juntarse formando dos tipos de "vecindarios": moléculas y redes atómicas. Las moléculas son como pequeños grupos de amigos (átomos) que se unen de forma estable mediante enlaces químicos.
Las redes atómicas son diferentes: imagínate un patrón que se repite una y otra vez, como los azulejos de tu baño. Los átomos se organizan en estructuras ordenadas que se extienden en todas las direcciones.
Ambas estructuras son súper estables y solo se pueden romper mediante procesos químicos, no con métodos físicos simples.
La Teoría Atómica: Las Reglas del Juego
La teoría atómica nos explica cómo funcionan los cambios en la materia. Los átomos son partículas diminutas, invisibles e invariables que tienen masa y propiedades específicas.
Hoy sabemos que los átomos están formados por partículas aún más pequeñas y que se organizan para formar moléculas y redes atómicas. Esta teoría se basa en el modelo cinético-corpuscular, que nos ayuda a entender cómo se comporta la materia.
Recuerda esto para el examen: Los átomos ni se crean ni se destruyen en las reacciones químicas, solo se reagrupan de formas diferentes.
Reacciones Químicas: El Arte de Reagruparse
Las reacciones químicas son como un baile donde los átomos cambian de pareja. Los enlaces que mantienen unidos a los átomos en las moléculas se rompen, y luego los átomos se reagrupan estableciendo nuevos enlaces.
El resultado son moléculas completamente nuevas con propiedades diferentes. Es importante recordar que los átomos no desaparecen ni aparecen de la nada, simplemente cambian de compañeros de baile.
La Tabla Periódica: El DNI de los Elementos
Cada elemento tiene su propia "tarjeta de identidad" en la tabla periódica. El símbolo (como Na para el sodio) es como un código universal que todos los científicos del mundo entienden.
El número atómico identifica de forma única a cada elemento, mientras que la masa atómica nos dice cuánto pesan sus protones y neutrones juntos.
Las fórmulas químicas nos dicen exactamente qué átomos y cuántos hay en cada sustancia. Por ejemplo, H₂O significa que hay 2 átomos de hidrógeno y 1 de oxígeno.
Estructura Atómica: Por Dentro del Átomo
Los átomos tienen una estructura fascinante: un núcleo central donde viven los protones (carga positiva) y neutrones (sin carga), rodeado por una nube electrónica donde se mueven los electrones (carga negativa).
Los isótopos son átomos del mismo elemento que tienen diferente número de neutrones. Algunos son estables, otros son radiactivos y se descomponen naturalmente.
Los iones son átomos que han ganado o perdido electrones: los cationes tienen carga positiva (perdieron electrones) y los aniones tienen carga negativa (ganaron electrones).
Truco para recordar: Los cationes son como gatos que han perdido algo (electrones) y están tristes (+), los aniones están contentos (-) porque ganaron electrones.
Caracterizar los Átomos: Su Carnet de Identidad
Para identificar completamente un átomo necesitas dos números clave: el número atómico (Z) que te dice cuántos protones tiene, y el número másico (A) que es la suma de protones y neutrones.
Se escriben así: ¹²₆C, donde 12 es el número másico y 6 el número atómico del carbono. Con esta información puedes saber todo sobre cualquier átomo.