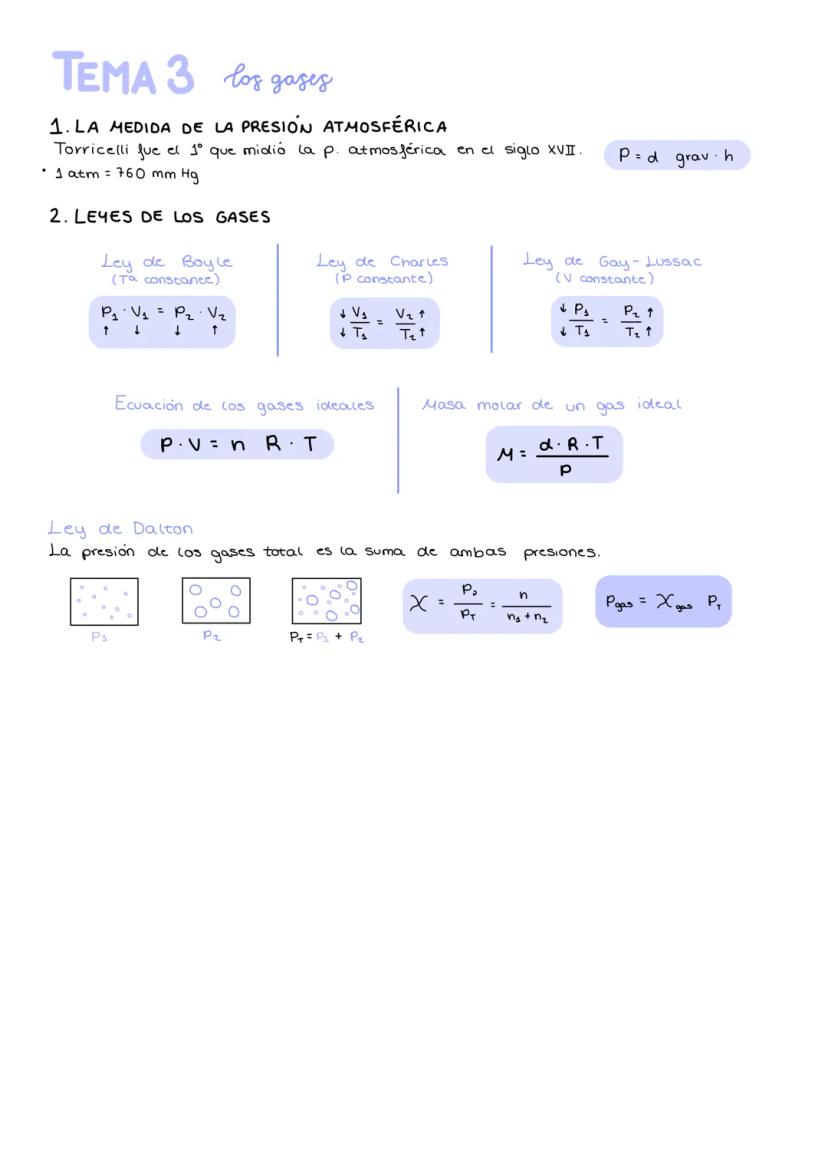
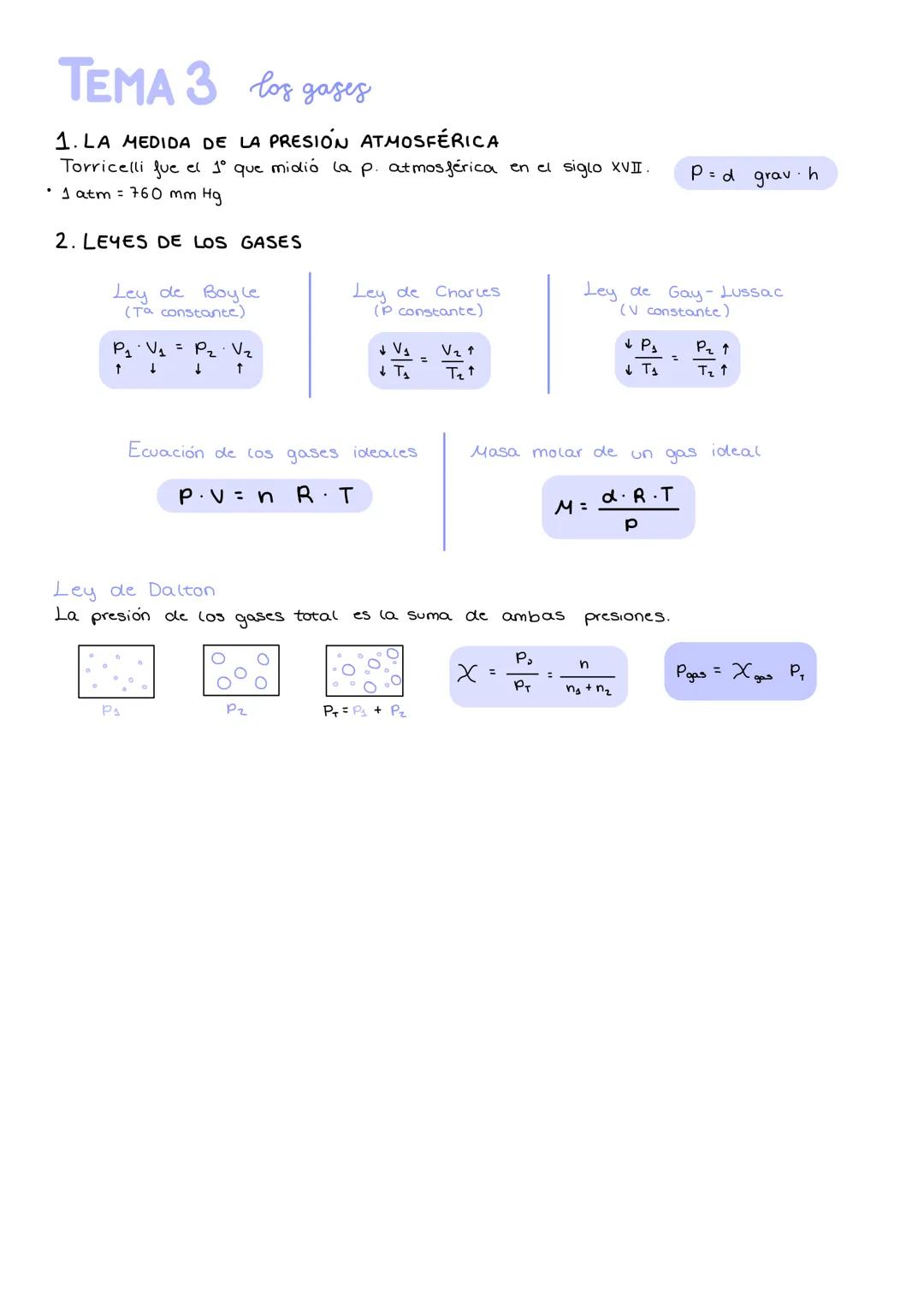
Primeras leyes de la química y teoría atómica
Las primeras leyes químicas establecen reglas básicas que toda reacción debe cumplir. La ley de conservación de la masa te dice que la masa total antes y después de una reacción es siempre la misma: nada se crea ni se destruye, solo se transforma.
La ley de Proust explica por qué el agua siempre tiene la misma composición: cuando dos elementos se combinan, siempre lo hacen en las mismas proporciones. Por su parte, la ley de Dalton nos ayuda a entender compuestos diferentes del mismo elemento, como Fe₂O₂ y Fe₂O₃.
Dalton propuso su teoría atómica para explicar estas leyes: la materia está formada por átomos indivisibles, cada elemento tiene átomos únicos, y en las reacciones los átomos solo se reordenan. Las leyes volumétricas de Gay-Lussac y la hipótesis de Avogadro completaron el puzzle, explicando que algunos gases existen como moléculas diatómicas (H₂, O₂).
Truco clave: Recuerda que las leyes químicas son como reglas del juego que nunca se rompen. Si entiendes esto, resolver problemas será mucho más fácil.