Propiedades de los Aminoácidos y Formación de Péptidos
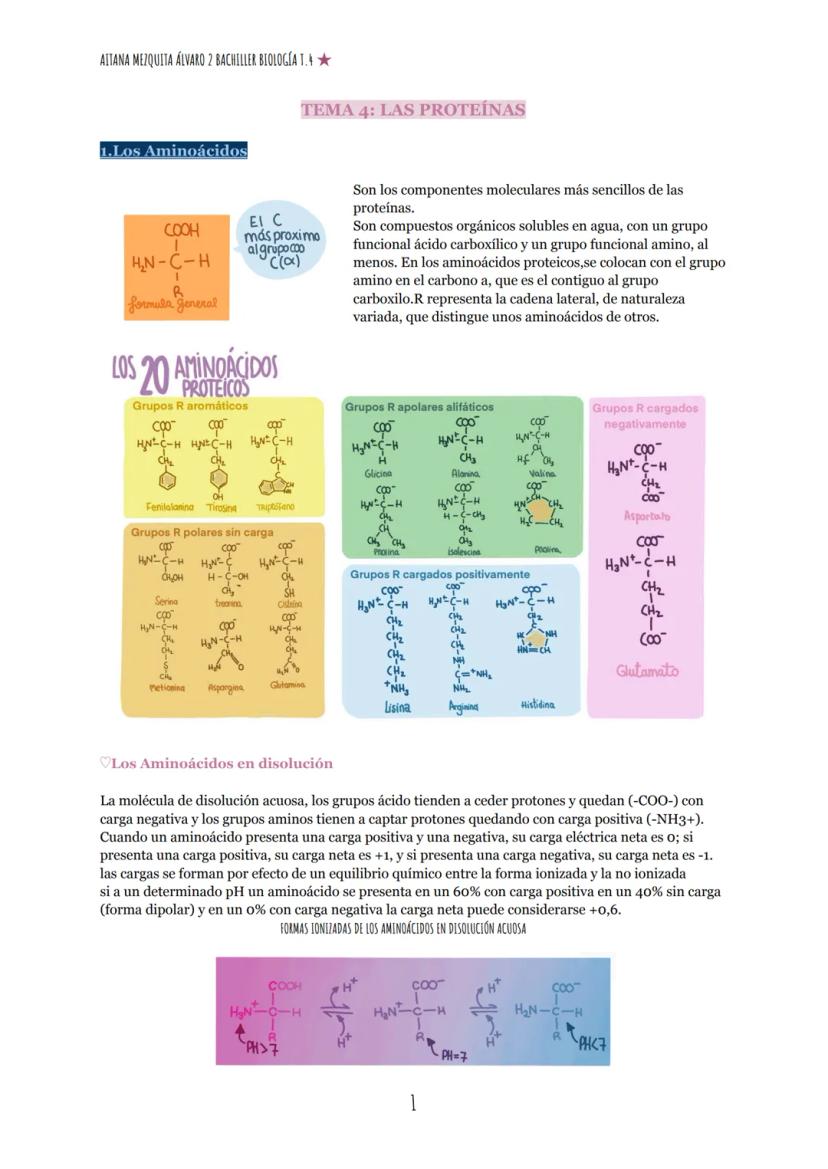
Los aminoácidos presentan comportamientos eléctricos distintos según su estructura. Aquellos con grupos carboxilo en su cadena lateral (aspartato y glutamato) tienen carga neta −1 a pH neutro, mientras que los que contienen grupos amino adicionales (lisina, arginina, histidina) presentan carga neta +1.
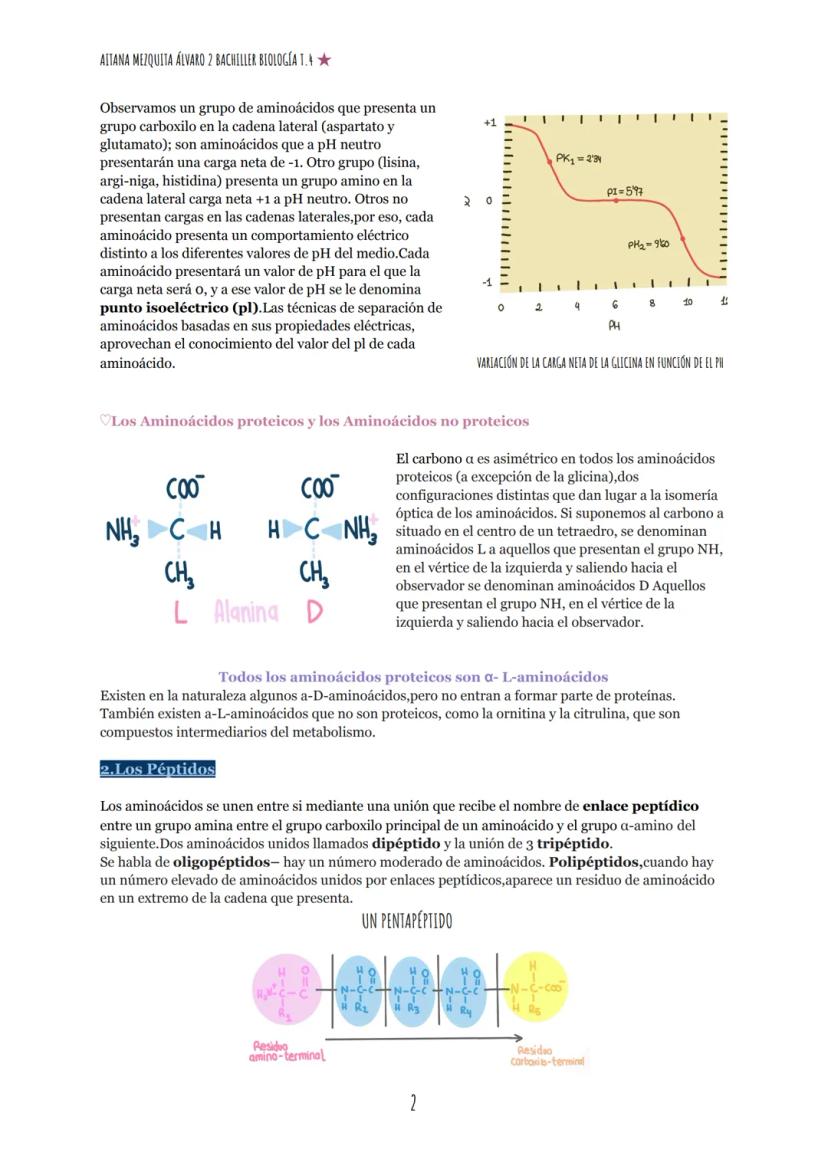
Casi todos los aminoácidos proteicos tienen un carbono α asimétrico que les confiere isomería óptica. Pueden existir en dos configuraciones espaciales: L-aminoácidos y D-aminoácidos. Todos los aminoácidos proteicos son α-L-aminoácidos, aunque existen en la naturaleza α-D-aminoácidos y α-L-aminoácidos no proteicos (como la ornitina y citrulina).
Los aminoácidos se unen entre sí mediante enlaces peptídicos, formando cadenas. Esta unión se produce entre el grupo carboxilo de un aminoácido y el grupo α-amino del siguiente. Según el número de aminoácidos unidos, se forman:
- Dipéptidos (2 aminoácidos)
- Tripéptidos (3 aminoácidos)
- Oligopéptidos (número moderado de aminoácidos)
- Polipéptidos (número elevado de aminoácidos)
🔍 Importante: En una cadena peptídica siempre existe un extremo con grupo amino libre N−terminal y otro con grupo carboxilo libre C−terminal, lo que da direccionalidad a la cadena.







COOH
$H_\text{N](/_next/image?url=https%3A%2F%2Fcontent-eu-central-1.knowunity.com%2FCONTENT%2F01960284-46d8-7824-837b-4e93198d4627_image_page_1.webp&w=2048&q=75)

COOH
$H_\text{N](/_next/image?url=https%3A%2F%2Fcontent-eu-central-1.knowunity.com%2FCONTENT%2F01960284-46d8-7824-837b-4e93198d4627_image_page_2.webp&w=2048&q=75)

COOH
$H_\text{N](/_next/image?url=https%3A%2F%2Fcontent-eu-central-1.knowunity.com%2FCONTENT%2F01960284-46d8-7824-837b-4e93198d4627_image_page_3.webp&w=2048&q=75)

COOH
$H_\text{N](/_next/image?url=https%3A%2F%2Fcontent-eu-central-1.knowunity.com%2FCONTENT%2F01960284-46d8-7824-837b-4e93198d4627_image_page_4.webp&w=2048&q=75)

COOH
$H_\text{N](/_next/image?url=https%3A%2F%2Fcontent-eu-central-1.knowunity.com%2FCONTENT%2F01960284-46d8-7824-837b-4e93198d4627_image_page_5.webp&w=2048&q=75)

COOH
$H_\text{N](/_next/image?url=https%3A%2F%2Fcontent-eu-central-1.knowunity.com%2FCONTENT%2F01960284-46d8-7824-837b-4e93198d4627_image_page_6.webp&w=2048&q=75)

COOH
$H_\text{N](/_next/image?url=https%3A%2F%2Fcontent-eu-central-1.knowunity.com%2FCONTENT%2F01960284-46d8-7824-837b-4e93198d4627_image_page_7.webp&w=2048&q=75)

COOH
$H_\text{N](/_next/image?url=https%3A%2F%2Fcontent-eu-central-1.knowunity.com%2FCONTENT%2F01960284-46d8-7824-837b-4e93198d4627_image_page_8.webp&w=2048&q=75)